Especies de
arañas como agentes de control biológico natural de la “cigarrita marrón” (Tagosodes
orizicolus Muir) en el cultivo de arroz en el valle de Tumbes
Spider species as natural biological
control agents of the “brown planthopper” (Tagosodes orizicolus Muir) in
rice cultivation in the Tumbes valley
Pedro S. Castillo-Carrillo1;
Pedro G. Calle-Ulfe1; Jean C. Silva-Alvarez2, *
1 Facultad de Ciencias
Agrarias, Universidad Nacional de Tumbes. Ciudad Universitaria, Av. Universitaria S/N,
Tumbes. Perú.
2 Inca'Biotec
S.A.C., Tumbes, 24000. Perú.
*Autor
corresponsal: jcsa.jean@gmail.com (J. C. Silva-Alvarez).
ID
ORCID de los autores
P.S.
Castillo-Carrillo: https://orcid.org/0000-0002-0255-1047
J.C.
Silva-Alvarez: https://orcid.org/0000-0002-7026-4955
RESUMEN
Las arañas son parte de la fauna benéfica presente
en los agroecosistemas de arroz en Tumbes y cumplen un rol fundamental como
agentes de biocontrol de Tagosodes orizicolus Muir. Se hace necesario
conocer su biodiversidad para integrarlas en el manejo integrado de plagas. El
objetivo del estudio fue identificar las especies y sus fluctuaciones
poblacionales en el cultivo de arroz en el valle de Tumbes. El primer periodo
de evaluación fue durante octubre 2018 a enero 2019 en cultivos sembrados bajo
la modalidad de trasplante y de abril a junio de 2019 de siembra directa. Las
colectas fueron semanales, las técnicas de colecta fueron trampas de caída,
observación directa en un determinado número de plantas por m2 y
barrido con red entomológica. El material colectado fue llevado a los ambientes
del museo entomológico para su procesamiento, identificación y conservación. Se
recolectaron ejemplares pertenecientes a 18 familias, las más representativas fueron
Lycosidae (65,05%), Tetragnathidae (15,15%) y Oxyopidae (6,48%). Se
identificaron 37 especies y/o morfoespecies. Las más abundantes fueron Hogna
albemarlensis (45,57%), Arctosa minuta (12,46%) y Tetragnatha
nitens (10,63%). Este estudio representa la primera contribución al
conocimiento de la diversidad de arañas presentes en el cultivo de arroz en el
valle de Tumbes.
Palabras clave: Agroecosistema; arroz, gremios; Aranae
ABSTRACT
Spiders are part of the
beneficial fauna present in the rice agroecosystem in Tumbes and play a
fundamental role as biocontrol agents of Tagosodes orizicolus Muir. It
is necessary to know their biodiversity to integrate them into integrated pest
management. The objective of the study was to identify the species and their
population fluctuations in rice cultivation in the Tumbes valley. The first
evaluation period was during October 2018 to January 2019 in crops sown under
the transplant modality and from April to June 2019 of direct sowing. The
collections were weekly, the collection techniques were fall traps, direct
observation in a certain number of plants per m2 and sweeping with
an entomological net. The collected material was taken to the entomological
museum environments for processing, identification and conservation. Specimens
belonging to 18 families were collected, the most representative were Lycosidae
(65.05%), Tetragnathidae (15.15%) and Oxyopidae (6.48%). 37 species and / or
morphospecies were identified. The most abundant were Hogna albemarlensis
(45.57%), Arctosa minuta (12.46%) and Tetragnatha nitens
(10.63%). This study represents the first contribution to the knowledge of the
diversity of spiders present in rice cultivation in the Tumbes valley.
Keywords: Agroecosystem; rice; guild; Aranae.
Recibido: 19-03-2021.
Aceptado: 24-05-2021.
El
arroz es uno de los cultivos de cereales más importantes de la humanidad, se
estima que aproximadamente 11% de la tierra cultivable en todo el mundo es
utilizada para la producción de arroz y los granos proporcionan el 20% de las
calorías para más de la mitad de la población mundial (Van Groenigen et al.,
2013; Gutaker et al.,
2020).
A nivel nacional el arroz en cáscara es el producto que más aporta al valor
bruto de la producción (VBP) de la actividad agrícola. Su valor de producción,
a precios constantes de 2007 representa el 13,1% del VBP del año 2018. Las
intenciones de siembra para la campaña 2019-2020 se proyectan en 413 281
hectáreas (Ministerio de Agricultura y Riego, 2020). Igualmente en el valle de
Tumbes este cultivo es uno de los más importantes, así durante el año 2017-2018
y 2018-2019, la superficie cosechada fue de 16636 y 15752 hectáreas (Ministerio
de Agricultura y Riego, 2019).
Actualmente,
este cultivo enfrenta diversidad de problemas fitosanitarios, algunos
provocados por efecto del cambio climático y otros por el manejo inadecuado de
plaguicidas que realiza el agricultor afectando a los enemigos naturales que
permiten la regulación natural de las poblaciones de insectos plagas, como son
arañas e insectos entomófagos, provocando un incremento explosivo de los
insectos plagas, la aparición de nuevas plagas y la adquisición de resistencia
a los plaguicidas aplicados dificultando de esta manera su control. Uno de los
insectos que en los últimos años ha adquirido importancia económica, es la “cigarrita
marrón” o “sogata” Tagosodes orizicolus Muir, que además de ocasionar
daños directos al alimentarse de la savia de la planta y ovipositar en ella, es
vector del “virus de la hoja blanca del arroz” provocando mermas en la
producción de hasta el 100%. (Martin et al., 2019; Liu et al., 2018, Morales
y Jennings, 2010, Backus et al., 2005).
Las
arañas son agentes eficaces de control biológico en el ecosistema de arroz
(Vivas-Carmona & Astudillo-García, 2017; Vinothkumar, 2012) y su población es
fluctuante en las diferentes etapas del cultivo y de acuerdo al nivel poblacional
de los insectos plagas. En estudios realizados en la India encontraron que Lycosa
pseudoannulata, Tetragnatha javana y Oxyopes javanus fueron
observadas durante todo el período de estudio. L. pseudoannulata presentó
las poblaciones más altas en la etapa vegetativa y T. javana
predominantemente durante las últimas etapas de la cosecha, y se precisa que la
aparición de arañas en diferentes días después del trasplante garantiza la
protección del cultivo contra los insectos fitófagos (Vinothkumar,
2012). Igualmente, Butt & Tahir (2010) en un área de monocultivo de un
ecosistema de arroz en Punjab, Pakistán, al investigar los factores
responsables de la coexistencia de tres especies de arañas cazadoras (Lycosa
terrestris, Pardosa birmanica y O. javanus) y dos especies de
arañas tejedoras de red orbitales (T. javana y Neoscona theisi), encontraron
que los miembros de ambos gremios se alimentaron de presas de los mismos
órdenes, pero en diferentes proporciones, los autores concluyen en que la
separación de los miembros del gremio en tiempo, micro hábitat y las
dimensiones del nicho de la presa redujo la competencia.
En
Colombia, en cultivos de arroz en el valle del Cauca, se han registrado 11
familias de arañas, representadas en 29 especies, siendo las más importantes
por frecuencia y abundancia Tetraganatha sp., T. straminea
(Tetragnathidae), Phidippus clarus (Salticidae), Synaemops
rubropunctatum (Thomisidae), Oxyopes salticus (Oxypidae), Argiope
argentata (Araneidae) y Pardosa sp., cerca de saxatilis
(Lycosidae), (Bastidas et al., 1994). En cambio, en el norte del Departamento
de Santander, se han registrado 21 especies de las cuales se han identificado
12, pertenecientes a siete familias y las tres especies de arañas más
abundantes son: Alpaida veniliae (Araneidae), Oxyopes salticus
(Oxyopidae) y Tetragnatha sp. (Tetragnathidae), (Cuevas, 1994).
El
control biológico que ocurre naturalmente en los diferentes agroecosistemas se evidencia
cuando el ambiente no es afectado por prácticas culturales erróneas,
principalmente con el uso indiscriminado de productos químicos, que afectan
tanto a las plagas, como a los enemigos naturales disponibles en el medio
ambiente (Huffaker & Messenger, 1976).
De lo
anteriormente descrito, se desprende la importancia del control biológico
natural y de que el conocimiento sobre las especies de arañas presentes en el
cultivo de arroz en Tumbes es inexistente. Por tal razón, se planteó esta investigación
que tuvo por objetivo determinar e identificar el número de especies de arañas
que actúan como agentes de control biológico natural de la “cigarrita marrón” (T.
orizicolus), así como evaluar sus fluctuaciones poblacionales en el cultivo
de arroz en el valle de Tumbes.
Área de estudio
El proyecto de
Investigación se ejecutó en la Facultad de Ciencias Agrarias de la Universidad
Nacional de Tumbes, (Sur 3°35´18,95” y Oeste: 80°30´16,54´´) en un campo con
una extensión de una hectárea de cultivo de arroz. El primer periodo de
evaluación se realizó durante octubre 2018 a enero 2019 bajo la modalidad de
siembra a trasplante y el segundo de abril a junio de 2019 bajo la modalidad de
siembra directa.
Fase de campo
Técnicas de muestreo. Se aplicaron
tres técnicas: empleo de red entomológica, búsqueda directa por m2 y
trampas de caída.
Técnica de búsqueda directa. Se elegía un m2
al azar por punto de evaluación y se revisaban las plantas dentro de esa
área para recolectar las arañas presentes. En el
primer periodo de evaluación (octubre 2018 - enero 2019), como el área
experimental fue sembrada en subparcelas en fechas distintas, se optó por
evaluar 1 m2 en cada subparcela. Para el segundo periodo de
evaluación, como toda el área de 1 ha había sido sembrada bajo el sistema de
siembra directa en una sola fecha de siembra se optó por evaluar 5 m2.
En este caso se tomaron 5 puntos al azar, evaluándose 1 m2 por punto
de evaluación. En ambos casos se contó el número de arañas presentes, en las
plantas o entre los macollos, para lo cual se hizo uso de un marco de 1 m2
de área confeccionado con tubos de PVC.
Técnica de trampas de caída. Se instalaron
10 trampas de caída o pitfall sobre los bordos que circundaban el área donde se
había sembrado el arroz. Las trampas consistían en depósitos plásticos de boca
ancha (12 cm de diámetro × 10 cm de profundidad de 1 L. de capacidad). Cada
trampa contenía 25 cm3 de formol, 225 cm3 de agua, a la
cual se le añadieron 2 gotas de jabón líquido para romper la tensión
superficial.
Fase de laboratorio
El material recolectado en campo fue llevado al Museo
Entomológico de la Facultad de Ciencias Agrarias de la Universidad Nacional de
Tumbes ubicado en el mismo campus, para su montaje, etiquetado, identificación y posterior
preservación.
Identificación de las especies
Con la ayuda de un microscopio estereoscopio, los
ejemplares fueron diferenciados en morfotipos y luego se realizó la
identificación a nivel de familias usando las claves de Jocqué & Dippenaar-
Shoeman (2006), Aguilera & Casanueva (2005), Levi (2002), Tikader &
Malhotra (1980), Kaston (1970), World Spider Catalog (2019 y 2020) y otra
literatura relacionada. Para corroborar la identificación realizada a nivel de
familias y realizar la identificación de los morfotipos a nivel de especie, el
material procesado fue enviado a los especialistas en arañas Diana Silva y Juan
Andia.
Asignación de gremios
Identificadas las especies de arañas por los
especialistas indicados, las familias registradas se agruparon en gremios para
lo cual se tuvo en cuenta la clasificación de Uetz et
al. (1999), la misma que constituye una clasificación específica desarrollada
por los autores citados para agroecosistemas, y que agrupan a las familias de
arañas encontradas en diversos tipos de cultivos en ocho gremios: corredoras de
follaje, corredoras terrestres, emboscadoras, acosadoras, tejedoras de hojas,
tejedoras en sábana, tejedoras espaciales y tejedoras orbiculares.
Análisis de datos
Para el análisis de los datos se tuvieron en cuenta los estados adultos de cada especie por familias, teniéndose en cuenta la suma de las arañas recolectadas de todas las evaluaciones en los dos periodos de evaluación y el total de las tres técnicas o modalidades de colecta. Con la finalidad de realizar un comparativo de los dos periodos de evaluación sembrados bajo dos modalidades diferentes de siembra, se tomaron en el caso del primer periodo los datos de solo tres meses (se excluyó el mes de enero debido a que solo se habían realizado dos evaluaciones y en la cual el arroz estaba completamente seco) y comparar con la otra modalidad de siembra y así poder aplicar los índices de diversidad de arañas de Shannon -Wiener (H1), que responde a la gran cantidad de cambios que se producen en especies raras en la comunidad y el índice de Simpson (λ), que es un índice sensible a los cambios que se producen en las especies más abundantes en una comunidad. Los estimadores Chao 1, Jacknife de 1° orden y las Curvas de acumulación de especies se evaluaron para todo el periodo que duró el estudio y se hizo uso del programa EstimateS 9.1.0 para Windows. Para la riqueza específica, los índices de dominancia de Simpson y de diversidad de Shannon-Wiener se evaluaron por modalidades o técnicas de siembra y se utilizó el programa Past 2.17c. La fluctuación poblacional de arañas se realizó teniendo en cuenta los dos periodos de evaluación y las tres técnicas de muestreo empleadas. Además, se evaluó la correlación lineal entre la abundancia de arañas con la temperatura y humedad relativa con el programa Excel.
Abundancia
de arañas
Se recolectaron un total de 4266 individuos
durante los nueve meses de estudio, la mayoría 2629 ejemplares, aprox. 61,6%
corresponde a estadios juveniles, de los cuales, aproximadamente, un 80%
corresponden a la familia Lycosidae. Esto constituye una densidad poblacional
de 0,4 arañas por m2 y la diferencia 1637 (38,4%) corresponden a los
adultos, en este caso las familias más abundantes fueron Lycosidae (65,05%),
Tetragnathidae (15,15%) y Oxyopidae (6,48%), (Tabla 1). Las especies más
abundantes fueron Hogna albemarlensis (45,57%) (Figura 1)., Arctosa
minuta (12,46%) (Figura 2) y Tetragnatha nitens (10,63%) (Figura 3).
Para propósitos de identificación taxonómica, los
estadios juveniles no fueron considerados porque no es posible identificarlos
con certeza ni siquiera a nivel de familia (Comunicación personal de los
especialistas que brindaron su apoyo en la identificación de las especies).

Figura 1. Hogna albemarlensis (Foto. Juan Andia)

Figura 2. Arctosa minuta (Foto: Juan Andia)
La correlación lineal entre la abundancia de
arañas al estado adulto y la temperatura resultó ser no significativa (r =
0,236) e igualmente para la humedad relativa (r = -0,2386), esto indica que
estos factores climáticos no tienen un marcado efecto sobre la población de
arañas.
Riqueza de arañas. El examen de los
ejemplares adultos (37%) resultó en un total de 37 especies y/o morfoespecies
(Tabla 1) y mostró la dominancia de Hogna albemarlensis (Banks, 1902)
sobre el resto de las especies (Figura 4). Las familias más ricas en especies
fueron Lycosidae y Theridiidae con cinco especies cada una, seguidas de
Tetragnathidae y Salticidae con cuatro. Los resultados indican que hay varios
nuevos registros para Perú y se ha observado la ocurrencia de varias especies
que sólo han sido reportadas para las islas Galápagos (Ecuador).

Figura 3. Tetragnatha nitens: (a) hembra adulta y (b) Quelíceros de hembra
adulta (Fotos: Juan Andia).
Diversidad de arañas. Los estimadores de
diversidad Chao 1 y Jack 1 presentan un valor de 40 y 30 especies cada uno, e
indican que tienen el 85 y 89% de las especies estimadas correspondien-temente.
La curva de acumulación de especies (Figura 4) no alcanzó la asíntota para el estimador
Jack 1 observándose aún en crecimiento, no así para el estimador Chao 1 que
comienza a decrecer. Esto indica según el estimado de Jack 1 que el
agroecosistema del cultivo de arroz tiene una mayor riqueza esperada de arañas
que la registrada.

Figura 4. Curva de acumulación de especies de arañas en el cultivo de
arroz. Corrales, Tumbes, Perú.
Tabla 1
Lista de familias, especies
y morfoespecies de arañas registradas en el cultivo de arroz. (* = recolectada
por búsqueda directa en m2, **= recolectada por redada doble y ***=
recolectada por trampa de caída)
|
Gremios
|
Familias
|
Especies y/o morfoespecies
|
Técnica de
colecta
|
Individuos
totales por técnica de colecta
|
|
|
|
Corredoras de follaje
|
Anyphaenidae
|
Anyphaenoides pacifica (Banks,1902)
|
***
|
(1)
|
|
|
Corredoras
terrestres
|
Gnaphosidae
|
Zelotes laetus (O.
Pickard-Cambridge,1872)
|
***
|
(77)
|
|
|
Camillina piura Platnick & Shadab, 1982
|
***
|
(3)
|
|
|
Lycosidae
|
Hogna albemarlensis (Banks, 1902)
|
***
|
(746)
|
|
|
Arctosa minuta F.O. Pickard - Cambridge, 1902
|
***,*
|
(197),(7)
|
|
|
Hogna hendrickxi Baert & Maelfait, 2008
|
***
|
(55)
|
|
|
Hogna subaustralis (Strand, 1908)
|
***
|
(36)
|
|
|
Hogna espanola Baert & Maelfait, 2008
|
***
|
(24)
|
|
|
Miturgidae
|
Teminius hirsutus (Petrunkevitch, 1925)
|
***,*
|
(2),(4)
|
|
|
Oonopidae
|
Ischnothyreus peltifer (Simon, 1892)
|
***
|
(1)
|
|
|
Pisauridae
|
Pisauridae sp.
|
***
|
(1)
|
|
|
Scytodidae
|
Scytodes sp.
|
***
|
(1)
|
|
|
Trachelidae
|
Trachelas daubei (Schmidt, 1971)
|
***
|
(2)
|
|
|
Acosadoras
|
Oxyopidae
|
Oxyopes salticus Hentz, 1845
|
***, **,*
|
(70),(23),(7)
|
|
|
Oxyopes incantatus (Santos, 2017)
|
**,*
|
(1),(5)
|
|
|
Salticidae
|
Salticidae sp. 1
|
***, **
|
(3),(7)
|
|
|
Salticidae sp. 2
|
***,**
|
(2),(2)
|
|
|
Salticidae sp. 3
|
**
|
(1)
|
|
|
Salticidae sp. 4
|
**
|
(1)
|
|
|
Emboscadoras
|
Thomisidae
|
Misumenops sp.
|
**,*
|
(1),(6)
|
|
|
Tejedoras orbiculares
|
Araneidae
|
Alpaida leucogramma (White, 1841)
|
***,**,*
|
(3),(3),(6)
|
|
|
Parawixia kochi (Taczanowski, 1873)
|
**
|
(2)
|
|
|
Tetragnathidae
|
Tetragnatha nitens (Audouin, 1826)
|
**,*
|
(144),(30 )
|
|
|
Tetragnatha elongata Walckenaer, 1841
|
**,*
|
(54),(10 )
|
|
|
Glenognatha argyrostilba (O.Pickard-Cambridge,
1876)
|
***,**
|
(1)(8)
|
|
|
Leucage sp.
|
**
|
(1)
|
|
|
Tejedoras en sabana
|
Linyphiidae
|
Mermessus denticulatus (Banks, 1898)
|
**,*
|
(4),(4)
|
|
|
Labicymbium sp.
|
***,**,*
|
(1),(1), (3)
|
|
|
Mermessus sp.
|
***,**
|
(3),(2 )
|
|
|
Tejedoras
espaciales
|
Dictynidae
|
Phantyna mandibularis (Taczanowski, 1874)
|
***,**,*
|
(4),(2),(3)
|
|
|
Mysmenidae
|
Mysmenus sp.
|
**
|
(1)
|
|
|
Theridiidae
|
Theridion volubile Keyserling, 1884
|
***,**,*
|
(6),(9),(7)
|
|
|
Theridion coldeniae (Baert & Maelfait, 1986)
|
***,**,*
|
(1),(2),(9)
|
|
|
Theridion sp. 2
|
**,*
|
(5),(7)
|
|
|
Theridion melanostictum Pickard-Cambridge, 1876
|
**,*
|
(3),(4)
|
|
|
Theridion sp. 3
|
*
|
(4)
|
|
|
Titanoecidae
|
Goeldia patellaris (Simon, 1893)
|
***
|
(4)
|
|
Gremios de arañas. Se registraron siete
gremios de arañas de acuerdo a la clasificación de Uetz et al. (1999) (Tabla 1).
El gremio más abundante fue el de corredoras terrestres (70,62%) (Tabla 2) y
también el gremio con mayor riqueza (siete familias y 12 especies (Tabla 1), siendo
la familia Lycosidae la más abundante (92,13%), en el de tejedoras orbiculares la
familia Tetragnathidae (94,66%), en el de acosadoras la familia más abundante
fue Oxyopidae (86,90%), en el caso del gremio de tejedoras espaciales la
familia más abundante fue Theridiidae (85,92%), en los gremios de las tejedoras
espaciales, tejedoras en sabana, emboscadoras y corredoras de follaje solamente
se presentó una familia.
Tabla 2
Distribución porcentual de individuos por gremios
de arañas registradas en el cultivo de arroz
|
Gremios de arañas
|
Porcentaje
|
|
Corredoras terrestres
|
70,62
|
|
Tejedoras orbiculares
|
16,00
|
|
Acosadoras
|
7,45
|
|
Tejedoras espaciales
|
4,34
|
|
Tejedoras en sabana
|
1,10
|
|
Emboscadoras
|
0,43
|
|
Corredoras de follaje
|
0,06
|
Fluctuación poblacional de las arañas al estado
adulto recolectadas por mes mediante las tres técnicas de colecta, en relación
con la temperatura
El mes con mayor presencia de arañas al estado
adulto fue diciembre (Tabla 3) donde el cultivo se había ya establecido y
existía una mayor cobertura vegetal. El mes con el menor número de individuos
recolectados fue febrero, mes cuando ya no existía cultivo de arroz, solo la
vegetación circundante.
Tabla 3
Número total de individuos adultos de arañas
recolecta-das mediante las tres técnicas de colecta por familia registradas en
el cultivo de arroz en relación con la temperatura (°C) y la humedad relativa (%)
|
Mes
|
Individuos
|
T °C
|
H.R.%
|
|
Octubre
|
134
|
26,8
|
64
|
|
Noviembre
|
194
|
29,4
|
67
|
|
Diciembre
|
323
|
30,7
|
65
|
|
Enero
|
174
|
29,6
|
66
|
|
Febrero (*)
|
130
|
31,2
|
70
|
|
Marzo (*)
|
182
|
31,0
|
71
|
|
Abril
|
153
|
30,8
|
69
|
|
Mayo
|
156
|
30,2
|
69
|
|
Junio
|
191
|
29,1
|
68
|
|
Total
|
1637
|
|
|
(*)
= ausencia de cultivo.
Fluctuación poblacional de arañas (adultos +
ninfas) promedio por m2
En la Tabla 4 y Figura 5 se presenta la población
de arañas por mes en relación con la temperatura y humedad relativa. Se aprecia
que en ambos periodos de evaluación hay un incremento gradual de las
poblaciones hasta la etapa fenológica de floración maduración, luego se produce
un descenso como consecuencia del secado de la planta y su posterior cosecha.
Tabla 4
Total de arañas por m2
y por mes en relación con la temperatura (°C) y la humedad relativa (%)
|
Mes
|
Individuos
|
T °C
|
H.R.%
|
|
Octubre
|
6
|
26,8
|
65
|
|
Noviembre
|
21
|
29,4
|
67
|
|
Diciembre
|
25
|
30,8
|
66
|
|
Enero
|
9
|
29,5
|
72
|
|
Febrero (*)
|
0
|
31,2
|
70
|
|
Marzo (*)
|
0
|
31,1
|
71
|
|
Abril
|
9
|
25,3
|
67
|
|
Mayo
|
25
|
28,3
|
66
|
|
Junio
|
21
|
30,3
|
64
|
|
Total
|
116
|
|
|
(*)
= ausencia de cultivo.
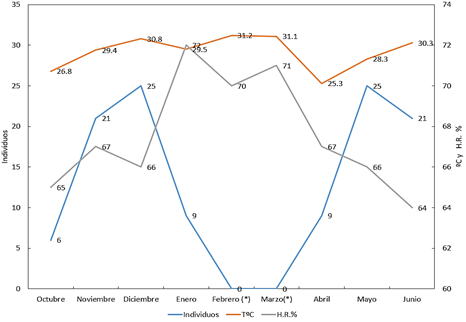
Figura 5. Fluctuación poblacional
de arañas adultas por mes y por m2.
(*) = ausencia de cultivo durante febrero y marzo.
Fluctuación poblacional de arañas recolectadas con
trampa de caída
La familia que presenta un mayor número de
especies es Lycosidae y las especies más abundante fueron H. albemarlensis
y Arctosa minuta (Tabla 5). La segunda familia en importancia es
Gnaphosidae con la especie Zelotes laetus y la tercera es Oxyopidae con
la especie Oxyopes salticus.
Fluctuación poblacional de arañas recolectadas con
red entomológica
En la Tabla 6 se observa que las familias que
presentan un mayor número de especies son Tetragnathidae, Theridiidae y
Salticidae, siendo las especies más abundante Tetragnatha nitens y Tetragnatha
elongata. En la primera siembra hay una población inicial alta, probablemente
por la colonización inicial del cultivo y luego en ambos periodos de siembra se
aprecia un incremento poblacional de las especies citadas durante el tercer mes
de instalado el cultivo donde existe una cobertura vegetal mayor y un mayor
número de presas al ingresar la planta a la fase de floración- maduración.
En la Tabla 7 se aprecia que, mediante la observa-ción
directa en las plantas contenidas en un m2, las familias que
presentan un mayor número de ejemplares por especie son Tetragnathidae,
Theridiidae y Oxyopidae, siendo las especies más abundantes T. nitens y T.
elongata. Tanto en el primer periodo de evaluación como el segundo se
inicia una colonización desde las primeras etapas fenológicas del cultivo hasta
el tercer mes de instalado coincidiendo con la fase de floración- maduración,
luego se produce un descenso.
Análisis de la fluctuación poblacional de arañas
al estado adulto por sistema de siembra
Con la finalidad de emplear la información
obtenida durante la ejecución del proyecto de investigación, y debido a causas
presupuestales la segunda instalación de cultivo se realizó con la finalidad de
ampliar el periodo de evaluación y tuvo que hacerse bajo la modalidad de
siembra directa, proporcionando como resultado dos ambientes totalmente
diferentes. Para realizar el análisis de diversidad se consideró evaluar tres
meses en ambos sistemas de siembra, teniéndose en cuenta además que, del
análisis de la temperatura y la humedad relativa, estos dos factores climáticos
no tuvieran una influencia determinante.
Tabla 5
Fluctuación poblacional de especies
por familia de arañas recolectadas por mes y por trampa de caída
|
Familias y especies
|
2018
|
2019
|
Total de
individuos
|
|
Oct
|
Nov
|
Dic
|
Ene
|
Feb
|
Mar
|
Abr
|
May
|
Jun
|
|
Lycosidae
|
|
|
|
|
|
|
|
|
|
|
|
Hogna albemarlensis
|
53
|
61
|
166
|
83
|
92
|
91
|
82
|
28
|
76
|
732
|
|
Arctosa minuta
|
8
|
38
|
14
|
15
|
17
|
30
|
18
|
26
|
31
|
197
|
|
Hogna hendrickxi
|
0
|
3
|
7
|
9
|
0
|
14
|
8
|
8
|
6
|
55
|
|
Hogna subaustralis
|
0
|
2
|
16
|
2
|
0
|
6
|
2
|
0
|
8
|
36
|
|
Hogna espanola
|
0
|
2
|
4
|
5
|
0
|
2
|
5
|
2
|
4
|
24
|
|
Gnaphosidae
|
|
|
|
|
|
|
|
|
|
|
|
Zelotes laetus
|
2
|
13
|
12
|
7
|
8
|
14
|
8
|
9
|
4
|
77
|
|
Camillina piura
|
0
|
1
|
0
|
1
|
0
|
0
|
0
|
1
|
0
|
3
|
|
Oxyopidae
|
|
|
|
|
|
|
|
|
|
|
|
Oxyopes salticus
|
1
|
6
|
3
|
15
|
11
|
10
|
8
|
8
|
8
|
70
|
|
Theridiidae
|
|
|
|
|
|
|
|
|
|
|
|
Theridion volubile
|
0
|
1
|
1
|
1
|
0
|
2
|
0
|
0
|
1
|
6
|
|
Theridion coldeniae
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
1
|
|
Salticidae
|
|
|
|
|
|
|
|
|
|
|
|
Salticidae sp. 1
|
0
|
1
|
0
|
0
|
0
|
1
|
0
|
1
|
0
|
3
|
|
Salticidae sp. 2
|
0
|
1
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
2
|
|
Dictynidae
|
|
|
|
|
|
|
|
|
|
|
|
Phantyna
mandibularis
|
0
|
1
|
0
|
0
|
1
|
0
|
0
|
1
|
1
|
4
|
|
Titanoecidae
|
|
|
|
|
|
|
|
|
|
|
|
Goeldia patellaris
|
0
|
0
|
1
|
0
|
0
|
1
|
0
|
1
|
1
|
4
|
|
Araneidae
|
|
|
|
|
|
|
|
|
|
|
|
Alpaida leucogramma
|
1
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
1
|
3
|
|
Miturgidae
|
|
|
|
|
|
|
|
|
|
|
|
Teminius hirsutus
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
1
|
0
|
2
|
|
Trachelidae
|
|
|
|
|
|
|
|
|
|
|
|
Trachelas daubei
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
0
|
1
|
2
|
|
Anyphaenidae
|
|
|
|
|
|
|
|
|
|
|
|
Anyphaenoides
pacifica
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
1
|
|
Oonopidae
|
|
|
|
|
|
|
|
|
|
|
|
Ischnothyreus
peltifer
|
0
|
0
|
0
|
0
|
1
|
0
|
0
|
0
|
0
|
1
|
|
Pisauridae
|
|
|
|
|
|
|
|
|
|
|
|
Pisauridae sp.
|
0
|
0
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
1
|
|
Scytodidae
|
|
|
|
|
|
|
|
|
|
|
|
Scytodes sp.
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
1
|
|
Tetragnathidae
|
|
|
|
|
|
|
|
|
|
|
|
Glenognatha
argyrostilba
|
0
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
Tabla 6
Fluctuación poblacional de
familias y especies de arañas adultas recolectadas con red entomológica
|
Familias y
especies
|
2018
|
2019
|
Total de
individuos
|
|
Oct
|
Nov
|
Dic
|
Ene
|
Feb
|
Mar
|
Abr
|
May
|
Jun
|
|
Tetragnathidae
|
|
|
|
|
|
|
|
|
|
|
|
Tetragnatha nitens
|
43
|
11
|
34
|
14
|
0
|
0
|
9
|
31
|
5
|
147
|
|
Tetragnatha
elongata
|
8
|
13
|
9
|
1
|
0
|
0
|
0
|
4
|
16
|
51
|
|
Glenognatha
argyrostilba
|
2
|
0
|
3
|
0
|
0
|
0
|
0
|
3
|
0
|
8
|
|
Leucage sp.
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
0
|
0
|
1
|
|
Oxyopidae
|
|
|
|
|
|
|
|
|
|
|
|
Oxyopes salticus
|
4
|
1
|
8
|
1
|
0
|
0
|
0
|
8
|
1
|
23
|
|
Oxyopes incantatus
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
1
|
|
Theridiidae
|
|
|
|
|
|
|
|
|
|
|
|
Theridion volubile
|
2
|
4
|
0
|
0
|
0
|
0
|
0
|
2
|
1
|
9
|
|
Theridion sp. 2
|
0
|
1
|
1
|
0
|
0
|
0
|
0
|
0
|
3
|
5
|
|
Theridion
melanostictum
|
0
|
1
|
0
|
2
|
0
|
0
|
0
|
0
|
0
|
3
|
|
Theridion coldeniae
|
1
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
0
|
2
|
|
Salticidae
|
|
|
|
|
|
|
|
|
|
|
|
Salticidae sp. 1
|
0
|
2
|
3
|
0
|
0
|
0
|
0
|
2
|
0
|
7
|
|
Salticidae sp. 2
|
0
|
0
|
1
|
1
|
0
|
0
|
0
|
0
|
1
|
3
|
|
Salticidae sp. 3
|
0
|
0
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
1
|
|
Salticidae sp. 4
|
0
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
|
Linyphiidae
|
|
|
|
|
|
|
|
|
|
0
|
|
Mermessus
denticulatus
|
0
|
0
|
1
|
1
|
0
|
0
|
0
|
2
|
0
|
4
|
|
Mermessus sp.
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
2
|
0
|
2
|
|
Labicymbium sp.
|
0
|
0
|
1
|
0
|
0
|
0
|
0
|
0
|
0
|
1
|
Tabla 7
Fluctuación poblacional de
especies por familia de arañas recolectadas mediante observación directa
|
Familias y especies
|
2018
|
2019
|
Total de
individuos
|
|
Oct
|
Nov
|
Dic
|
Ene
|
Feb (*)
|
Mar (*)
|
Abr
|
May
|
Jun
|
|
Tetragnathidae
|
|
|
|
|
|
|
|
|
|
|
|
Tetragnatha nitens
|
3
|
6
|
8
|
2
|
0
|
0
|
3
|
6
|
2
|
30
|
|
Tetragnatha elongata
|
1
|
2
|
2
|
1
|
0
|
0
|
0
|
2
|
2
|
10
|
|
Theridiidae
|
|
|
|
|
|
|
|
|
|
|
|
Theridion coldeniae
|
0
|
2
|
1
|
1
|
0
|
0
|
0
|
3
|
2
|
9
|
|
Theridion sp. 2
|
0
|
2
|
1
|
1
|
0
|
0
|
0
|
1
|
2
|
7
|
|
Theridion volubile
|
0
|
0
|
3
|
0
|
0
|
0
|
0
|
3
|
1
|
7
|
|
Theridion melanostictum
|
0
|
1
|
0
|
1
|
0
|
0
|
0
|
1
|
1
|
4
|
|
Theridion sp. 3
|
0
|
1
|
1
|
0
|
0
|
0
|
0
|
0
|
2
|
4
|
|
Oxyopidae
|
|
|
|
|
|
|
|
|
|
|
|
Oxyopes salticus
|
0
|
0
|
1
|
1
|
0
|
0
|
1
|
3
|
1
|
7
|
|
Oxyopes incantatus
|
0
|
1
|
1
|
0
|
0
|
0
|
1
|
0
|
2
|
5
|
|
Lycosidae
|
|
|
|
|
|
|
|
|
|
|
|
Arctosa minuta
|
2
|
2
|
0
|
0
|
0
|
0
|
0
|
2
|
1
|
7
|
|
Araneidae
|
|
|
|
|
|
|
|
|
|
|
|
Alpaida leucogramma
|
0
|
2
|
1
|
0
|
0
|
0
|
0
|
2
|
1
|
6
|
|
Thomisidae
|
|
|
|
|
|
|
|
|
|
|
|
Misumenops sp.
|
0
|
0
|
2
|
1
|
0
|
0
|
1
|
1
|
1
|
6
|
|
Linyphiidae
|
|
|
|
|
|
|
|
|
|
|
|
Mermessus denticulatus
|
0
|
0
|
2
|
1
|
0
|
0
|
1
|
0
|
0
|
4
|
|
Labicymbium sp.
|
0
|
0
|
1
|
0
|
0
|
0
|
1
|
0
|
1
|
3
|
|
Miturgidae
|
|
|
|
|
|
|
|
|
|
|
|
Teminius hirsutus
|
0
|
1
|
0
|
0
|
0
|
0
|
1
|
0
|
2
|
4
|
|
Dictynidae
|
|
|
|
|
|
|
|
|
|
|
|
Phantyna mandibularis
|
0
|
1
|
1
|
0
|
0
|
0
|
0
|
1
|
0
|
3
|
(*)
= ausencia de cultivo durante febrero y marzo.
Abundancia de arañas. La mayor abundancia en el
sistema de siembra trasplante se registró durante el tercer mes (diciembre) y
la menor en el primer mes (octubre) (Tabla 8). En el sistema de siembra
directa hubo una menor abundancia, pero igualmente la mayor abundancia se presentó
en el tercer mes (junio) y la menor durante el primer mes (Tabla 9).
Riqueza de arañas. La riqueza especifica fue
ligeramente mayor en el sistema de siembra directa (31 especies- Tabla 9) y
menor en el sistema de siembra por trasplante (28 especies -Tabla 8).
Tabla 8
Fluctuación poblacional de
familias y especies de arañas adultas recolectadas mediante tres técnicas de
colecta en la modalidad de siembra por trasplante
|
Especies y/o
morfoespecies
|
Siembra trasplante
|
Total
|
|
|
|
Oct
|
Nov
|
Dic
|
|
|
|
|
|
1. Hogna albemarlensis (Banks, 1902)
|
53
|
75
|
166
|
294
|
|
|
|
2. Tetragnatha nitens (Audouin, 1826)
|
46
|
17
|
42
|
105
|
|
|
|
3. Arctosa minuta F.O. Pickard - Cambridge, 1902
|
10
|
40
|
14
|
64
|
|
|
|
4. Tetragnatha elongata Walckenaer, 1841
|
9
|
15
|
11
|
35
|
|
|
|
5. Zelotes laetus (O.
Pickard-Cambridge,1872)
|
2
|
13
|
12
|
27
|
|
|
|
6. Oxyopes salticus Hentz, 1845
|
5
|
7
|
12
|
24
|
|
|
|
7. Hogna subaustralis (Strand, 1908)
|
0
|
2
|
16
|
18
|
|
|
|
8. Theridion volubile Keyserling, 1884
|
2
|
5
|
4
|
11
|
|
|
|
9. Hogna hendrickxi Baert & Maelfait, 2008
|
0
|
3
|
7
|
10
|
|
|
|
10. Alpaida leucogramma (White, 1841)
|
2
|
2
|
3
|
7
|
|
|
|
11. Glenognatha argyrostilba (O.Pickard-Cambridge,
1876)
|
2
|
0
|
4
|
6
|
|
|
|
12. Hogna espanola Baert & Maelfait, 2008
|
0
|
2
|
4
|
6
|
|
|
|
13. Salticidae sp. 1
|
0
|
3
|
3
|
6
|
|
|
|
14. Phantyna mandibularis (Taczanowski, 1874)
|
1
|
3
|
1
|
5
|
|
|
|
15. Theridion coldeniae (Baert & Maelfait, 1986)
|
1
|
2
|
2
|
5
|
|
|
|
16. Theridion sp. 2
|
0
|
3
|
2
|
5
|
|
|
|
17. Mermessus denticulatus (Banks, 1898)
|
0
|
0
|
3
|
3
|
|
|
|
18. Misumenops sp.
|
0
|
0
|
3
|
3
|
|
|
|
19. Labicymbium sp.
|
0
|
1
|
2
|
3
|
|
|
|
20. Mermessus sp.
|
0
|
0
|
2
|
2
|
|
|
|
21. Oxyopes incantatus (Santos, 2017)
|
0
|
1
|
1
|
2
|
|
|
|
22. Parawixia kochi (Taczanowski, 1873)
|
1
|
0
|
1
|
2
|
|
|
|
23. Salticidae sp. 2
|
0
|
2
|
0
|
2
|
|
|
|
24. Theridion melanostictum Pickard-Cambridge, 1876
|
0
|
2
|
0
|
2
|
|
|
|
25. Theridion sp. 3
|
0
|
1
|
1
|
2
|
|
|
|
26. Camillina piura Platnick & Shadab, 1982
|
0
|
1
|
0
|
1
|
|
|
|
27. Goeldia patellaris (Simon, 1893)
|
0
|
0
|
1
|
1
|
|
|
|
28. Teminius hirsutus (Petrunkevitch, 1925)
|
0
|
1
|
0
|
1
|
|
|
|
Total
|
134
|
200
|
319
|
653
|
|
|
Tabla 9
Fluctuación poblacional de
familias y especies de arañas adultas recolectadas mediante tres técnicas de
colecta en la modalidad de siembra directa
|
Especies y/o morfoespecies
|
Siembra
directa
|
Total
|
|
|
|
Abr
|
May
|
Jun
|
|
|
|
|
|
1. Hogna albemarlensis (Banks, 1902)
|
82
|
28
|
76
|
186
|
|
|
|
2. Arctosa minuta F.O. Pickard - Cambridge, 1902
|
18
|
28
|
32
|
78
|
|
|
|
3. Tetragnatha nitens (Audouin, 1826)
|
12
|
37
|
7
|
56
|
|
|
|
4. Oxyopes salticus Hentz, 1845
|
9
|
19
|
10
|
38
|
|
|
|
5. Tetragnatha elongata Walckenaer, 1841
|
0
|
6
|
18
|
24
|
|
|
|
6. Hogna hendrickxi Baert & Maelfait, 2008
|
8
|
8
|
6
|
22
|
|
|
|
7. Zelotes laetus (O. Pickard-Cambridge,1872)
|
8
|
9
|
4
|
21
|
|
|
|
8. Hogna espanola Baert & Maelfait, 2008
|
5
|
2
|
4
|
11
|
|
|
|
9. Hogna subaustralis (Strand, 1908)
|
2
|
0
|
8
|
10
|
|
|
|
10. Theridion volubile Keyserling, 1884
|
0
|
5
|
3
|
8
|
|
|
|
11. Theridion coldeniae (Baert & Maelfait, 1986)
|
0
|
3
|
3
|
6
|
|
|
|
12. Theridion sp. 2
|
0
|
1
|
5
|
6
|
|
|
|
13. Alpaida leucogramma (White, 1841)
|
0
|
2
|
3
|
5
|
|
|
|
14. Oxyopes incantatus (Santos, 2017)
|
1
|
0
|
3
|
4
|
|
|
|
15. Teminius hirsutus (Petrunkevitch, 1925)
|
1
|
2
|
1
|
4
|
|
|
|
16. Glenognatha argyrostilba (O.Pickard-Cambridge,
1876)
|
0
|
3
|
0
|
3
|
|
|
|
17. Mermessus denticulatus (Banks, 1898)
|
1
|
2
|
0
|
3
|
|
|
|
18. Misumenops sp.
|
1
|
1
|
1
|
3
|
|
|
|
19. Phantyna mandibularis (Taczanowski, 1874)
|
0
|
1
|
2
|
3
|
|
|
|
20. Salticidae sp. 1
|
0
|
3
|
0
|
3
|
|
|
|
21. Goeldia patellaris (Simon, 1893)
|
0
|
1
|
1
|
2
|
|
|
|
22. Labicymbium sp.
|
1
|
0
|
1
|
2
|
|
|
|
23. Mermessus sp.
|
0
|
2
|
0
|
2
|
|
|
|
24. Theridion melanostictum Pickard-Cambridge, 1876
|
0
|
1
|
1
|
2
|
|
|
|
25. Theridion sp. 3
|
0
|
0
|
2
|
2
|
|
|
|
26. Anyphaenoides pacifica (Banks,1902)
|
0
|
0
|
1
|
1
|
|
|
|
27. Camillina piura Platnick & Shadab, 1982
|
0
|
1
|
0
|
1
|
|
|
|
28. Leucage sp.
|
1
|
0
|
0
|
1
|
|
|
|
29. Salticidae sp. 2
|
0
|
0
|
1
|
1
|
|
|
|
30. Scytodes sp.
|
0
|
0
|
1
|
1
|
|
|
|
31. Trachelas daubei (Schmidt, 1971)
|
0
|
0
|
1
|
1
|
|
|
|
Total
|
150
|
165
|
195
|
510
|
|
|
Diversidad de arañas. El
valor más alto de la diversidad de Shanon –Wiener se presentó en la modalidad
de siembra directa (H´= 2,28) que se corresponde con el mayor número de
especies registradas y el menor en la modalidad de siembra por trasplante (H´=
2,02); en cambio el índice de dominancia de Simpson fue mayor en la modalidad
de siembra al trasplante (ƛ = 0,25) que se corresponde con el mayor número
de individuos adultos de arañas colectados y el menor en la siembra directa
(ƛ = 0,18) (Tabla 10).
Tabla 10
Análisis de diversidad de
la araneofauna en el cultivo de arroces recolectada mediante tres técnicas de
colecta en dos modalidades de siembra
|
Índices
|
Periodos de
evaluación
|
|
Oct-dic 2018
|
Abr- jun 2019
|
|
Modalidad de
siembra
|
|
Trasplante
|
Directa
|
|
Riqueza especifica (S)
|
28
|
31
|
|
Shannon -Wiener(H´)
|
2,02
|
2,28
|
|
Dominancia de Simpson (ƛ)
|
0,25
|
0,18
|
|
Diversidad de Simpson (1- ƛ)
|
0,75
|
0,82
|
Gremios de arañas. El
gremio de las corredoras terrestres fue el más abundante en ambas modalidades
de siembra, siendo ligeramente mayor en la de siembra directa (65,7%). Los
gremios que registraron las menores abundancias fue el de las emboscadoras en
la modalidad de siembra a trasplante (0,5%) y en la de siembra directa el de
las corredoras de follaje (0,2%). Así mismo, la mayor riqueza de gremios se
presentó en ambos casos a partir del segundo y tercer mes cuando en ambas
modalidades se encuentra una mayor cobertura vegetal y especialmente en el
tercer mes cuando los cultivos ingresan a la etapa fenológica de floración.
Arañas
como depredadores en el cultivo de arroz
Del
total de 4266 ejemplares recolectados, 2626 (63%) correspondieron a estadios
juveniles. El predominio de arañas al estado juvenil guarda relación con lo
reportado por Pérez-Guerrero et al. (2009) y Almada et al.
(2012), para cultivos de algodón en España (91,07%) y Argentina (60%)
respectivamente. Además, coinciden con otros trabajos realizados en cultivos y
áreas naturales (Almada et al., 2012; Avalos et al., 2013), donde más
del 60% fueron individuos juveniles. Esto podría deberse a una constante
colonización de las arañas juveniles desde los márgenes del cultivo hacia éste
(Almada et al., 2012). Las densidades de arañas varían con la fenología del
cultivo, en ambos tipos de siembra se ha observado que las poblaciones se
incrementan gradualmente con la edad del cultivo, esto concuerda con los
resultados encontrados y con lo que reporta (Liu et al., 2003).
Del
examen de los ejemplares adultos que constituyó el 37% de los ejemplares
recolectados se tuvo un total de 37 morfo especies, algunas de las cuales
lograron ser identificadas a nivel de especie y otras a nivel de género y se muestra
la dominancia de H. albemarlensis sobre el resto de las especies
recolectadas. No existe información específica sobre estas especies
en cultivos de arroz, pero si información general sobre la presencia de la
familia Lycosidae en agroecosistemas del cultivo de arroz. Rodrigues
et al. (2013), por ejemplo, refieren que las arañas se encuentran en casi todos
los ecosistemas, incluidos los agrícolas como el arroz y que, entre las
familias de arañas al estado adulto presentes en los cultivos de arroz, una de
las más abundantes es Lycosidae, situación similar es reportada para el
continente asiático por Tahir & Butt (2010) en Pakistán donde encontraron
que Lycosidae fue la familia dominante y comprendió el 77,67% de la captura
total, del mismo modo Jayakumar & Sankari, (2010) en India reportan un
total de ocho especies de arañas pertenecientes a siete familias diferentes,
siendo Lycosa pseudoannulata Boes & Stand una de las que se presenta
en las diferentes etapas del cultivo y cuando la población de plagas se
incrementa e indican que las poblaciones más altas suceden en la etapa de
crecimiento temprano, resultados similares encontró Butt & Tahir (2010)
para Pakistán al investigar los factores responsables de la coexistencia de
tres especies de arañas cazadoras (Lycosa terrestris, Pardosa
birmanica y Oxyopes javanus).
Para
Sudamérica, Bao et al. (2019) en Uruguay indican que las familias más
abundantes fueron Lycosidae, Linyphiidae, Anyphaenidae y Tetragnathidae (26%,
25%, 20% y 12%, respectivamente) y representaron más del 80% de la abundancia
relativa total. Fritz et al., (2008), para Brasil, manifiestan que las familias
de arañas comúnmente encontradas en arroz irrigado son Araneidae, Lycosidae,
Tetragnathidae y Salticidae, así mismo Bastidas et al. (1994) para Colombia,
reportan haber registrado para el mismo cultivo 11 familias, representadas en
29 especies.
La abundancia de los
individuos por familia también estaría relacionada con las técnicas de colecta
y esfuerzos de muestreo realizados en cada investigación, siendo cada resultado
muy particular, como el de este trabajo de investigación. Al respecto (Rubio et
al., 2007) sostienen que la gran abundancia de Lycosa sp.1,
posiblemente se deba, a las técnicas de muestreo utilizadas, ya que según estos
autores las trampas de caída y el cernido de hojarasca, son métodos eficientes
para la colecta de este tipo de araña, cuya característica principal de
comportamiento es que presenta una actividad epigea.
En lo correspondiente a
especies de la familia Tetragnathidae para el continente asiático, se ha
registrado a Tetragnatha maxillosa Thorell para Filipinas (Shepard et
al. 1987), quienes a su vez destacan que los ejemplares de esta especie
descansan en la parte superior de las plantas de arroz y construyen redes
débiles durante la noche para depredar cigarritas. comportamiento similar observado
en el trabajo realizado. Butt & Tahir (2010) para Pakistán registran a T.
javana., Katti et al., (2001) para la India y destacan que arañas del
género Tetragnatha son comunes en los campos de arroz. Bambaradeniya et
al. (2004) en Sri Lanka reportan para el citado cultivo a las especies T.
javana y T. nitens, estas dos especies también son reportadas
por Shawer et al. (2012) en Egipto.
Para Sudamérica; Fritz et al.
(2008) en Brasil, señalan a Tetragnatha como el género más abundante en
colectas de arañas, Rodrigues et al. (2008) para el mismo país reporta la
presencia de Tetragnatha nitens, y Tetragnatha aff. jaculator
y así mismo, Rodrigues et al. (2005) y Rodrigues et al. (2013) destacan la
dominancia de T. nitens (46,8%) y T. jaculator (14,8%). Vivas-Carmona
& Astudillo-García (2017) en Venezuela identificaron a las especies T.
nitens, T. pallescens, T. vermiformis y resaltan que estas
especies constituyen un excelente método de control natural de las plagas
importantes y que desde el punto de vista ecológico constituyen un componente
elemental en el manejo integrado de plagas en el cultivo de arroz.
Con relación a la especie Oxyopes
salticus. Rodrigues et al. (2008) en muestreos realizados con jama
entomológica en Brasil encontró niveles poblacionales similares a los
encontrados en el estudio realizado, en el orden de haber recolectado estos
autores, solamente cuatro ejemplares. En el caso del presente trabajo de
investigación, dichos valores son similares con número de dos a cinco en las
observaciones realizadas por m2. Sin embargo, en las colectas con
red entomológica, los mayores valores registrados fueron de 14 individuos
adultos durante el periodo octubre 2018-enero 2019 y de nueve durante abril-junio
2019, pero mayor, en las trampas de caída que en un periodo continuo de colecta
se recolectaron 70 ejemplares.
Cabe indicar que durante los
dos periodos de evaluación y las dos modalidades de siembra no se observó ni se
colectó a una especie del género Argiope que fuera observada por el
autor principal de este estudio con mucha frecuencia en campos de cultivos de arroz
durante los años 1986-2000.
En lo referente a los dos
factores climáticos que se tuvieron en cuenta en esta investigación para su
análisis, como son la temperatura y la humedad relativa su influencia no fue
relevante, similares resultados son reportados por Vijaykumar (2004) quien no
encontró correlación significativa de la temperatura y humedad con las arañas en
un cultivo de arroz en India, situación parecida es reportada por Rodrigues et
al. (2009) para Brasil.
En lo concerniente a la
riqueza encontrada en el presente trabajo de investigación (37 especies y/o
morfoespecies y 18 familias) esta es similar a la encontrada en Brasil por Rodrigues
et al. (2008) (38 morfoespecies y 14 familias); pero mucho menor a lo citado
por Sudhikumar et al. (2005) para la India.
Los resultados indican que
hay varios nuevos registros para Perú y se ha observado la ocurrencia de varias
especies que sólo han sido reportadas para las islas Galápagos (Ecuador) (Baert
et al., 2008, Baert & Maelfait, 1986) así tenemos: A. minuta, H.
albemarlensis, H. española, Terminius hirsutus, Ischnothyreus
peltifer, Oxyopes incantatus, Theridion coldeniae, Theridion
melasnotictum y Trachelas daubai.
En este estudio Lycosidae,
Theridiidae y Tetragna-thidae fueron las familias con mayor riqueza de especies
(14%, 14% y 11%, respectivamente); Sudhikumar et al., (2005) para la India,
registraron a Salticidae, Tetragnathidae y Araneidae con mayor número de
especies con el 18%, 13% y 12%. La mayor riqueza de especies de Lycosidae podría
deberse que esta familia hace sus nidos en áreas circundantes a los campos de
cultivo, donde existe una menor perturbación antrópica por el manejo agronómico
y de la maquinaria.
Análisis de la fluctuación
poblacional de adultos por sistemas de siembra
La mayor abundancia de arañas
al estado adulto se presenta durante la fase de floración- maduración en los
dos sistemas empleados. La mayor población de arañas en el sistema de siembra
trasplante podría deberse a que en este sistema existe mucho mayor espacio
entre golpes (grupos de plantas) sobre todo en el tercio medio e inferior de
las plantas, posibilitando mejores refugios y en los cuales las arañas pueden
desplazarse con mayor facilidad más no así en el sistema de siembra directa,
donde los espacios son muy reducidos y las plantas están muy juntas y no propician condiciones para hábitats o refugios para las
arañas, dificultando de alguna manera el desarrollo de sus poblaciones y
desplazamientos, afectando más a los gremios de las tejedoras orbiculares, las
acosadoras y las tejedoras en sabana. Cabe indicar que después de realizado el
trasplante la colonización es lenta y la recuperación de las poblaciones de
arañas se logra mediante la reproducción, pero también de la inmigración de los
hábitats circundantes tal como lo expresan Bao et al. (2019), Thorbek &
Topping (2005), Thorbek & Bilde (2004) y Ryptstra et al. (1999).
Análisis de la fluctuación
poblacional de adultos por técnicas de colecta
La técnica de colecta de
trampa de caída registró la mayor asociación de especies y familias, pero igual
número de gremios con las otras dos técnicas exceptuando los gremios de
emboscadoras (ausen-tes en las trampas de caída) y la de corredoras de follaje
(ausentes en la de observación directa y barrido con red entomológica). Aunque
por el mayor número de individuos colectadas en trampas de caída, el gremio de
las corredoras terrestres resultó ser la más abundante, al parecer por sus
mismos hábitos de nidificación que tienen, se desarrollan en los terrenos que
permanecen inalterados después de los bordes del cultivo y de la vegetación
herbácea y es posible que puedan eludir de alguna manera la alta presión de
insecticidas que se utiliza en el cultivo de arroz, más no así las tejedoras
orbiculares y de sabana, que para su multiplicación necesitan de la
arquitectura de la planta para construir sus redes y estas están mucho mayor
expuestas a las aplica-ciones de insecticidas. Esto pudo ser observado durante
el desarrollo del estudio, cuando se realizaba una aplicación de insecticidas
para dismi-nuir la alta presión poblacional de T. orizicolus sobre el
cultivo, la población de arañas descendía. Esto concuerda con lo argumentado
por Amalin et al. (2001) quienes indican que las prácticas de manejo agronómico
convencionales, como, por ejemplo, el trasplante, la aplicación de insecticidas,
fungicidas y herbicidas, que tienen efectos indirectos sobre la población de
arañas, los herbicidas pueden reducir la población de insectos fitófagos que se
desarrollan en la vegetación herbácea de bordes, lo que resulta en una menor
disponibilidad de presas para las arañas.
En lo que corresponde a las
arañas como depredadores no específicos de insectos plagas y en relación con T.
orizicolus se registró una alta riqueza y abundancia en el agroecosistema
del cultivo de arroz, estando presentes con fluctuaciones en las diferentes
etapas fenológicas del cultivo, iniciándose en ambas modalidades de siembra con
bajas poblaciones, las que se fueron incrementando en la medida que la
plantación ofrecía una mayor arquitectura y frondosidad cubriendo los espacios
y presentando un mayor canopi, con lo cual se ofrecía una mayor presencia de
insectos fitófagos y en especial las poblaciones del insecto plaga T.
orizicolus y otras especies de fitofagos. Se recolectaron 18 familias, que
representaban siete gremios, el más abundante fue el de las corredoras
terrestres, las familias más abundantes fueron Lycosidae (65,05%),
Tetragnathidae (15,15%) y Oxyopidae (6,48%). Se identificaron 37 especies y/o
morfoespecies. Las más abundantes fueron H. albemarlensis (45,57%), A.
minuta (12,46%) y T. nitens (10,63%). La cosecha y la
ausencia del principal insecto fitófago marca un inicio en la disminución de la
población de arañas. La temperatura y humedad no mostraron una marcada
influencia en la araneofauna que pudo registrarse en el estudio realizado. El
gremio de las tejedoras orbiculares y en especial la familia Tetragnatidae
resulta interesante porque su presencia puede ser corroborada por el personal
profesional y técnico e incluso el agricultor, durante todas las fases del
cultivo por los hábitos de comportamiento que presenta, al descansar en las
hojas del tercio superior de las plantas, pero este hábito hace que sus
poblaciones sean más afectadas cuando se realizan aplicaciones de agroquímicos,
especialmente insecticidas. Este estudio representa la primera contribución al
conocimiento de su biodiversidad al agro ecosistema del arroz en valle de
Tumbes. Por lo tanto, se hace necesario continuar evaluando la biodiversidad
de las arañas del cultivo, en otras áreas diferentes a las del estudio, así
mismo es importante realizar estudios de capacidad de depredación de las
especies de arañas más importantes y poder valorar el rol que estas cumplen en
la regulación de los principales insectos plagas que se presentan en el cultivo
de arroz. Del mismo modo se hace necesario evaluar el efecto real que los
distintos plaguicidas ejercen sobre la población de arañas especialmente las del
gremio de las tejedoras orbiculares.
A la Dra. Diana Silva Ávila profesora investigadora
de la Universidad Nacional Mayor de San Marcos y al Juan Manuel Andia Navarro investigador
Asociado al Museo de Entomología "Klaus Raven Büller" de la
Universidad Nacional Agraria La Molina por la identificación de las especies de
arañas. A las Ingenieras Agrónomas Rosa Emelda Cornejo Hidalgo y Patricia Cruz
Córdova, por su apoyo en las tareas de campo y de laboratorio. A La Universidad
Nacional de Tumbes por el financiamiento del trabajo de investigación con recursos
del canon y sobre canon en la modalidad de Proyectos de investigación en
ciencias aplicadas (nivel inicial).
REFERENCIAS
BIBLIOGRÁFICAS
Aguilera, M. A.
& Casanueva, M. E. (2005). Arañas chilenas, estado actual del conocimiento
y clave para las familias de Araneomorphae. Gayana 69(2),201-224.
Almada, M., Sosa,
M. & González, S. (2012). Araneofauna (Arachnida, Araneae) en cultivos de
algodón (Gossypium hirsutum) transgénicos y convencionales en el norte
de Santa Fe, Argentina. Revista de Biología Tropical. 60(2), 611-623.
Amalin, D. M.,
Peña, J. E., Mcsorley, R., Browning, H. W. & Crane, J. H. (2001). Comparison of different sampling methods and effect of
pesticide application on spider population in lime orchards in south Florida. Environ. Ent., 30, 1021-1027.
Avalos, G., Bar,
M., Oscherov, E. & González, A. (2013). Diversidad de Araneae en cultivos
de Citrus sinensis (Rutaceae) de la Provincia de Corrientes, Argentina. Revista de Biología Tropical. 61(3), 1243-1260.
Backus, E. A.,
Serrano, M. S. & Ranger, C. M. (2005). Mechanisms of hopperburn, an overview of insect
taxonomy, behavior, and physiology. Annu. Rev. Entomol. 50, 125–151.
Baert, L. & Maelfait,
J. P. 1986. A contribution to the knowledge of the spider fauna of Galápagos
(Ecuador). Bulletin van het Koninklijk Belgisch Instituut voor Natuurwetenschappen,
Entomologie, 56, 93-123.
Baert, L.,
Maelfait, J.P. & Hendrickx, F. (2008). The wolf spiders (Araneae,
Lycosidae) from the Galápagos Archipelago. Bulletin de l'Institut Royal des
Sciences Naturelles de Belgique, Entomologie 78, 5-37.
Bambaradeniya,
C.N.B., Edirisinghe, J.P., Hendrickx, De Silva, D.N., Gunatilleke, C.V.S.,
Ranawana, K.B. & Wijekoon, S. (2004). Biodiversity associated with an
irrigated rice agro-ecosystem in Sri Lanka. Biodiversity and
Conservation 13, 1715-1753.
Bao, L., Ginella, J.,
Cadenazzi, M., Castigglioni, E., Martinez, S., Casales, L., Caraballo, M.,
Laborda, A. & Simo, M. (2019). Spider
assemblages associated with different crop stages of irrigated rice
agroecosystems from eastern Uruguay. Biodiversity
Data Journal 6, e24974.
Bastidas, H.,
Pantoja, A., Murillo, A., Zuluaga, J. I. & Duque, M. C. (1994).
Reconocimiento, fluctuación y pruebas de consumo de presas por arañas en
cultivos de arroz, en el valle del Cauca. Revista Colombiana de Entomología 20(3),149-160.
Butt, A. & Tahir,
H. (2010). Resource partitioning among five agrobiont spiders of a rice
ecosystem. Zoological Studies 49(4), 470-480.
Cuevas, A. (1994).
Las arañas, Controladores naturales de
insectos fitófagos en el cultivo de arroz en Norte de Santander. Revista
Colombiana de Entomología 2083), 179-186.
Fritz, L., Arden,
E., Pandolfo, M., Martins, S., Vargas, J. & Fiuza, L. (2008).
Agroecosistemas orizicolas irrigados, Insetos-Praga, Inimigos Naturais. Oecol. Bras.12 (4), 720- 732.
Gutaker, R. M., Groen, S. C.,
Bellis, E. S., Choi, J. Y., Pires, I. S., et al. (2020). Genomic history and ecology of the geographic spread of rice.
Nat. Plants 6, 492-502.
Huffaker, C. B.
& Messenger, P. S. (1976). Theory and practice of biological control. New
York, Academic Press.
Jocqué, R. &
Dippenaar-Shoeman, A. S. (2006). Spider families of the world. Tervuren, Belgium,
Royal Museum for Central Africa. 336 p.
Jayakumar, S.
& Sankari, A. (2010). Spider population and their predatory efficiency in
different rice establishment techniques in Aduthural, Tamil Nadu. Journal
Biopesticides 3 (1 Special Isuue) 020-027.
Kaston, B. J. (1970).
How to know the spiders? WM. C. Brown Company Publishers Dubuque, Iowa. 220 pp.
Katti, G., Pasalu, I. C.,
Varma, N. R. G. & Dhandapani, N. (2001). Quantification of natural biological control in rice ecosystem for
possible exploitation in rice IPM. Indian Journal of Entomology 63,439-448.
Levi, H. W. (2002).
Keys to the genera of araneid orbweavers (Araneae, Araneidae) of the Americas.
Journal of Arachnology, 30,527–562.
Liu, W. X., Hou,
M. L., Wan, F. H. & Wang, F. L. (2003). Temporal and spatial niche dynamics
of spiders and their control effects on cotton bollworms in transgenic Bt.
cotton fields. Entomol. Know., 40,160- 163.
Liu, W.,
Hajano, J. U. & Wang, X. (2018). New insights on the
transmission mechanism of tenuiviruses by their vector insects. Curr. Opin.
Virol. 33, 13–17.
Martin, J. E., Bernal
E. K., Cruz, M. G., Zhu-Salzman K., Way M. O. & Badillo-Vargas, I. E. (2019).
Assessing the Potential Infection of Tagosodes orizicolus (Hemiptera,
Delphacidae) by Rice Hoja Blanca Virus in Texas Journal of Economic Entomology, 113(2), 1018-1022 - November 2019
Ministerio de Agricultura y Riego-MINAGRI. (2019).
Encuesta nacional de intenciones de siembra 2019. Lima, Perú, Dirección general
de seguimiento y evaluación de políticas dirección de estadística agraria
Ministerio de Agricultura y
Riego-MINAGRI. (2020). Plan Nacional de Cultivos Campaña Agrícola 2019- 2020.
Lima, Perú, Dirección general de seguimiento y evaluación de políticas
dirección de estadística agraria.
Morales, F. J.
& Jennings, P. R. (2010). Rice Hoja Blanca, a complex plant– virus–vector
pathosystem. CAB Rev. 5, 1–15.
Pérez-Guerrero,
S., Tamajón, R., Aldebis, H. & Vargas-Osuna, E. (2009). Comunidad de arañas
en cultivos de algodón ecológico en el sur de España. Revista colombiana de Entomología. 35(2), 168-172.
Rodrigues, E. N. L.,
de S. Mendonca, M. & Ott, R. (2008). Fauna de aranhas (Arachnida, Milton Araneae)
em diferents estagios do cultivo do arroz irrigado em Cachoeirinha, RS, Brasil.
Iheringia, Sér. Zool. Porto Alegre. 98(3), 362-371.
Rodrigues, E., de
Mendonca, M., Fritz, L. L., Heinrichs, E. A. & Fiuza, L. (2013). Effect of the insecticide Lambda-cyhalotrina on rice
spider populations in southern Brazil. Zoología 30(6), 615-622.
Rodrigues, E. N. L.,
M.S. Mendonca, J. R. & Ott. R. (2009). Spider diversity in a rice agroecosystem and adjacent areas in southern
Brazil. Revista Colombiana de Entomología 35, 78-86.
Rodrigues, E. N. L.,
Podgaiski, L. R., Ott, R., Oliveira, J. V. & JR, M. M. (2005). Aranhas e
suas formas de predacao na cultura de arroz irrigado (Oryza sativa) na Depresao
Central, RS. pp, 31-32. Anais do IV Congresso Brasileiro de Arroz irrigado, Santa María.
658 pp.
Rubio, G. D.,
Minoli, I. & Piacentini, L. (2007). Patrones de abundancia de cinco
especies de arañas lobo (Araneae, Lycosidae) en dos ambientes del Parque
Nacional Mburucuyá, Corrientes, Argentina. Brenesia, 67, 59-67.
Ryptstra, A. L.,
Carter, P.E., Balfour, R.A. & Marshall, S.D. (1999). Architectural feature
of agricultural habitats and their impacto in the spider in habitants. Journal
of Arachnology 27(1), 371-377.
Shawer, M. B.,
Sharshir, F. A., Hendawy, A. S. & Refaei, E. A. (2012). Survey of True
Spiders in the Egyptian Rice Fields at Rasheid Region Beheira Gavarnarte. J.
Plant Prot. and Path., Mansoura Univ., Vol. 3 (8), 835 – 842.
Shepard, B. M.,
Barrion, A. T. & Litsinger, J. A. (1987). Friends of the Rice Farmer,
Helpful Insects, Spiders, and Pathogens. International Rice Research Institute.
Los Baños, Laguna, Philippines. 127 pp.
Sudhikumar, A.,
Mundackatharappel, J., Enathayil, S. & Pothalil, A. (2005). Seasonal
variation in spider abundance in Kuttanad rice agroecosystem, Kerala, India
(Araneae). European Arachnology 2005 (Deltshev, C. & Stoev, P., eds) Acta
zoologica bulgarica, Suppl. No. 1, pp. 181-190.
Tahir, H. &
Butt, A. (2009). Effects of Different Management Practices and Field Margins on
the Abundance of Ground Spiders in Rice Ecosystems. J. Zool., 41(2), 85-93.
Thorbek, P. &
Bilde, T. (2004). Declines of generalist arthropod predators due to mortality,
emigration, or habitat disruption after tillage and grass cutting. Journal of
Applied Ecology 41, 526‑538.
Thorbek, P. &
Topping, C. J. (2005). The influence of landscape diversity and heterogeneity
on spatial dynamics of agrobiont linyphiid spiders, an individual-based model. BioControl, 50, 1‑33.
Tikader, B. K. & Malhotra,
M. S. (1980). Lycosidae (Wolf spiders). Fauna India (Araneae), 1, 248-447.
Uetz, G. W., Halaj, J. & Cady,
A. B. (1999). Guild Structure of Spiders In Major Crops
(1999). The Journal of Arachnology 27, 270-280.
Van Groenigen, K.
J., van Kessel, C. & Hungate, B. A., (2013). Increased greenhouse-gas
intensity of rice production under future atmospheric conditions. Nat. Clim.
Chang. 3, 288-291.
Vijaykumar, P. B.
V. (2004). Spider fauna of paddy ecosystem in selected areas of Tungabhadra
Project in Karnataka. Journal of Agricultural Sciences 17 (3), 584-585.
Vinothkumar, B. (2012).
Diversity of spider fauna in upland rice agroecosystem at Gudalur valley in
Tamilnadu. Journal of Biological Control, 26 (3),
222–229.
Vivas-Carmona, L. E. & Astudillo-García, D.H. (2017). Cuatro
especies de arácnidos (Arachnida, Araneae) en arrozales de Calabozo Estado
Guárico, Venezuela. J. Selva Andina
Biosphere 5(2),116-123.
World Spider
Catalog. Version 21.0. (2019). Natural History Museum Bern, online at
http://wsc.nmbe.ch, (acceso 15/12/2019).
World Spider
Catalog. Version 21.0. (2020). Natural History Museum Bern, online at
http://wsc.nmbe.ch, (acceso 15/02/2020).




