Principales
especies fitófagas y enemigos naturales registradas en el cultivo de quinua
Se consideraron importantes, debido al número de individuos
registrados y por el impacto al cultivo, las siguientes.
Liriomyza
huidobrensis (Diptera: Agromyzidae)
Las larvas fueron registradas a partir de dos hojas verdaderas.
Los porcentajes más altos de infestación (porcentaje de hojas con larvas vivas)
se registraron en las etapas de 4-6 hojas verdaderas (32%) y la segunda semana
de panojamiento (15,3%). El porcentaje más alto de hojas minadas se registró en
la etapa de 4-6 hojas verdaderas (40%). Al inicio de floración y primera semana
de floración no se registraron larvas debido a una infección severa por mildiú,
que ocasionó la caída de hojas en la planta. En la segunda semana de floración
se volvió a registrar un 11% de infestación. A partir de entonces la población
se mantuvo relativamente constante hasta la cosecha. Los adultos se registraron
desde la primera evaluación por red aérea en la etapa de 4-6 hojas verdaderas
hasta el final del cultivo. La población más alta de adultos (111 individuos mediante
red aérea), fue registrada en la primera semana de floración.
L. huidobrensis se presentó durante toda la etapa de
evaluación, similar a lo descrito en el cultivo de papa en la costa peruana (Cisneros
& Mujica, 1998).
Las pérdidas económicas por la infestación de L. huidobrensis
se han estimado en 15% en el cultivo de tomate (Lopes
et al., 2019) y es capaz de infestar severamente diversas plantas en el Perú,
en particular en localidades de la costa central (Weintraub
et al., 2017). También se ha reportado una asociación de L. huidobrensis
con el hongo Alternaria solani (Pleosporaceae) en cultivo de papa en
Brasil (Soares
et al., 2019).
Parasitoides
recuperados de larvas de L. huidobrensis
Se recuperaron 502 individuos parasitoides de 1169 larvas. Los más
abundantes fueron H. arduine (200 individuos, 39,84%), Diglyphus
sp. A (189 individuos, 37,65%) y Chrysocharis sp. A (98 individuos, 19,52%).
Otros parasitoides sumaron 15 individuos (3%). Estas especies fueron
registradas durante toda la etapa de evaluación. H. arduine fue más
abundante entre las etapas de 4-6 hojas verdaderas y panojamiento. Diglyphus
sp. A fue más abundante en la etapa de grano lechoso. Hacia el final del
cultivo la abundancia de parasitoides fue similar en las tres especies.
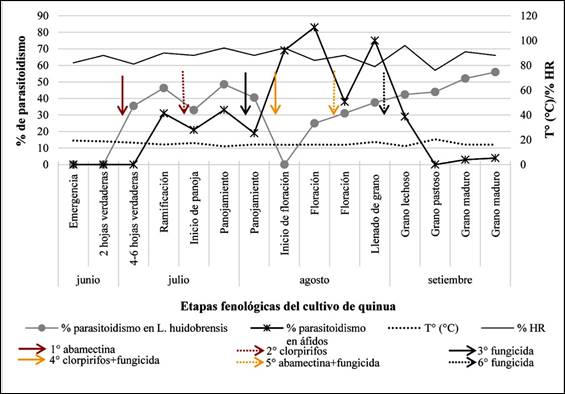
El primer registro de parasitoidismo ocurrió en la etapa de 4-6
hojas verdaderas (junio), con un porcentaje de parasitoidismo de 35,5%, luego
46,25% en la etapa de ramificación y 48,45% en panojamiento. Al inicio de
la floración no se registraron parasitoides (debido a la ausencia de hojas con
minas). En floración se registró 25% y fue incrementando hasta llegar a 55,88%
en la etapa de grano maduro (septiembre, última evaluación) (Figura 2). Esto se
asemeja a los resultados obtenidos por Cisneros
& Mujica (1998) en el cultivo de papa, de 35% al inicio de la
campaña en abril, hasta 55% de parasitoidismo al final del cultivo en agosto.
En el análisis de correlación entre las poblaciones de L.
huidobrensis y los parasitoides se obtuvo un coeficiente de 0,966
(significativa en el nivel 0,01 (bilateral)) lo que indica una relación
positiva muy fuerte entre ambas poblaciones (Hernández
et al., 2014).
De siete especies de parasitoides registrados en el cultivo de
quinua para la “mosca minadora”, seis corresponden a la familia Eulophidae y
una especie a Pteromalidae, coincidiendo en cierta medida con lo que obtuvieron
Cisneros
& Mujica (1998) y Mujica
& Kroschel (2013) en el cultivo de papa en Perú, y Callohuari
et al. (2018) en el cultivo de tarwi, también en la costa peruana.
H. arduine fue más abundante en las primeras
etapas de desarrollo del cultivo; a partir de floración, Diglyphus sp.
A, fue más abundante. Estos resultados se asemejan a lo obtenido por Redolfi
et al. (1985), Sánchez
& Redolfi (1988), Cisneros
& Mujica (1998), Mujica
& Kroschel (2011) y Mujica
& Kroschel (2013) en el cultivo de papa en la costa peruana,
quienes señalaron que Diglyphus websteri (Crawford) y H.
arduine fueron los más abundantes, por ende, los más importantes en la
regulación de la población de “mosca minadora”.
Las condiciones de humedad relativa (76 - 96%) y temperatura (14,7
– 20,4 °C) durante este estudio fueron favorables para la presencia de L.
huidobrensis (Mujica
et al., 2017; Rodríguez-Castañeda et al., 2017).
Prodiplosis
longifila Gagné (Diptera:
Cecidomyiidae)
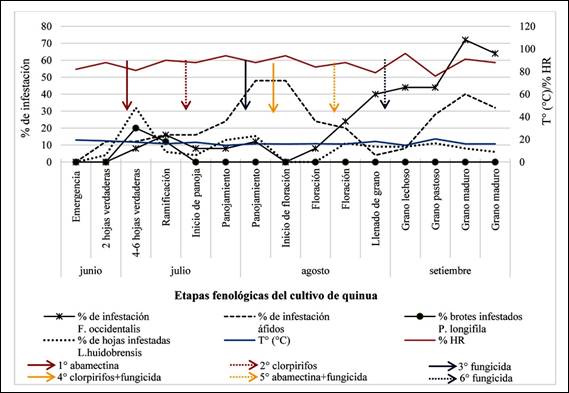
Solo se registraron larvas en brotes principales en la etapa de
4-6 hojas verdaderas (23 larvas en 25 brotes) y en ramificación (8 larvas en 25
brotes). Se registró un 20% de plantas infestadas en la etapa de 4-6 hojas
verdaderas (4,6 larvas por brote en promedio) y 12% en ramificación (2,7 larvas
por brote en promedio) (Figura 3). Los adultos solo fueron registrados mediante
trampas de caída en bajo número.
Se conoce que P. longifila afecta todos los estados
fenológicos que presentan brotes, en cultivos tales como, espárrago (Castillo
et al., 2020), cítricos y tomate en Colombia (Duque-Gamboa
et al., 2018; Velasco-Cuervo et al., 2016), sibidigua en Bolivia
(Dhileepan
et al., 2017), papa en Perú (Mujica
& Kroschel, 2019) entre otros cultivos. Sin embargo, en este
estudio no se registró infestación en las primeras etapas, pero sí después de
la presencia de 4-6 hojas verdaderas hasta el inicio de panojamiento.
Luego de la aplicación de abamectina se registró un descenso en el
número de plantas infestadas (Figura 3). La abamectina ha sido empleada para el
control de P. longifila en papa en Perú (Mujica
& Kroschel, 2019).
El rango de temperatura en el que se realizó este estudio fue de
14,7 °C a 20,4 °C, se encuentra dentro del rango favorable para el desarrollo
de P. longifila (Castillo
et al., 2020). Por otro lado, la humedad relativa estuvo en un rango de 76% y
96%, propicia para el desarrollo de P. longifila, como señalan Sarmiento
(1997) citado por Valarezo
et al. (2003) y Díaz
(1981).
La larva produjo raspaduras en las hojas tiernas de los brotes
principales al alimentarse, ocasionando como daño primario la deformación del
brote y el cese del crecimiento de la planta. En algunos brotes afectados se
desarrolló pudrición a causa de microorganismos patógenos, dadas las
condiciones de humedad y deshechos de la alimentación de las larvas. Las
plantas afectadas por esta especie desarrollaron una panoja deforme y menor en
comparación a plantas no afectadas. Estas observaciones coinciden con lo
señalado por Díaz
(1981) para los cultivos de alfalfa, papa y pallar.
Myzus
persicae, Macrosiphum euphorbiae (Hemiptera:
Aphididae)
Myzus persicae fue registrado a partir de 4-6 hojas
verdaderas (3 de individuos en 25 plantas), el mayor número de individuos se
registró en las etapas de inicio de panojamiento (23 individuos) y segunda
semana de panojamiento (19 individuos). Macrosiphum euphorbiae fue
registrado a partir de dos hojas verdaderas (2 individuos en 25 plantas), sin
embargo, el mayor registro de individuos fue en la segunda semana de grano
maduro (70 individuos). El porcentaje más alto de plantas infestadas por áfidos
(48%), se registró durante la segunda semana de panojamiento e inicio de
floración. M. persicae fue más abundante entre las etapas de 4-6 hojas
verdaderas e inicio de floración en comparación a M. euphorbiae, mientras
que este último fue más abundante en la etapa de grano maduro.
M. persicae y M. euphorbiae son especies
polífagas y cosmopolitas y han sido registrados en muchos otros cultivos tales
como, fresa en Argentina (Cingolani
& Greco, 2018), berenjena en Irán (Raeyat
et al., 2021), tomate en Italia (Trotta
et al., 2021), papa y tabaco en China (Liu
et al., 2019; Zhou et al., 2021) donde además de perjudicar a las
plantas por su alimentación, pueden convertirse en vectores de virus
fitopatógenos.
Aphidius colemani (Hymenoptera:
Braconidae)
Aphidius colemani fue registrado mediante red
aérea durante todo el periodo del cultivo, sin embargo, en la evaluación por
órgano de planta, solo fueron recuperados de Myzus persicae a partir de
la etapa de ramificación. El mayor número de parasitoides recuperados
fue en la primera semana de floración (15 individuos) lo que correspondió a un
porcentaje de parasitoidismo de 83% (Figura 2).
Es probable que este parasitoide haya tenido una influencia
importante sobre la población de áfidos, como ocurrió en el cultivo de trigo en
Alemania donde las avispas parasitoides tuvieron el efecto más fuerte en la
reducción del crecimiento de la población de áfidos en comparación a los
predadores (M.
H. Schmidt et al., 2003). En el cultivo de berenjena en
Brasil, un parasitoide de la familia Braconidae fue uno de los factores que
limitó el incremento de la población de áfidos (Leite
et al., 2006).
El rango de temperatura en el que se desarrolló este estudio
estuvo por debajo del rango de temperatura óptima para la actividad de A.
colemani, que se sitúa entre 25 °C a 30 °C (Zamani
et al., 2006).
Frankliniella
occidentalis (Pergande) (Thysanoptera: Thripidae)
Se registró desde la etapa de 4-6 hojas verdaderas (2 individuos).
En ramificación se registraron 10 individuos en 25 plantas, lo que representó
un 16% de infestación (Figura 3). A partir de la floración, la población de
esta especie se incrementó de manera sostenida, manteniendo ese patrón hasta la
cosecha. En la etapa de grano maduro se registró el mayor número de individuos
(49 individuos), con infestación de 72% (Figura 3). En la última evaluación se
registró un descenso en comparación a la penúltima evaluación, esto podría
deberse a que los adultos de F. occidentalis estarían migrando en busca
de cultivos más jóvenes. Todos estos patrones de abundancia y movimiento se
ajustan a lo descrito en estudios realizados en cultivos de lechuga, tomate y
cucurbitáceas (Healey
et al., 2017).
Uno de los factores más influyentes en la variación de la
población de F. occidentalis probablemente fueron las etapas de
desarrollo del cultivo. Las poblaciones altas ocurrieron a partir de
grano lechoso; sin embargo, Atakan
et al. (2016), Ren
et al. (2020) y Healey
et al. (2017) en otros cultivos, encontraron que la población máxima ocurrió en
la etapa de floración. Lo ocurrido en el cultivo de quinua quizá se debió al
estrés que sufrió la planta debido a la infección ocasionada por mildiu en la
etapa de inicio de floración (defoliación total de la planta), en ese momento,
el registro de trips fue muy escaso.
Las condiciones de temperatura y humedad relativa fueron
favorables para el desarrollo de F. occidentalis. El umbral mínimo de
temperatura para esta especie oscila entre 8-10 °C (Nielsen
et al., 2021), mientras que las temperaturas entre 25 - 30 °C y sin fuertes
variaciones, propician su desarrollo (Cao
et al., 2019), permitiendo que ocurran varias generaciones en una sola
temporada de cultivo (Reitz,
2009).
Atakan,
E., Ölçülü, M., Pehlivan, S., & Özgür, O. (2016). An analysis of western
flower thrips Frankliniella occidentalis (Pergande) (Thysanoptera :
Thripidae) in lemons: Its abundance, distribution and damage status. Journal
of Entomology and Zoology Studies, 4(2), 109–114.
Blackman,
R. L., & Eastop, V. F. (2000). Aphids on the world’s crops: An
identification an information guide. Wiley.
Blackman,
R. L., & Eastop, V. F. (2006). Aphids on the world ’ s herbaceous plants
and shrubs. Wiley.
Burrieza,
H. P., Rizzo, A. J., Moura Vale, E., Silveira, V., & Maldonado, S. (2019). Shotgun
proteomic analysis of quinoa seeds reveals novel lysine-rich seed storage
globulins. Food Chemistry, 293, 299–306.
Callohuari,
Y., Vergara, C., & Jiménez, J. (2018). Insect pests associated with Andean
lupin (Lupinus mutabilis Sweet) and their parasitoids in Peruvian central coast
– (Lima, La Molina). Peruvian Journal of Agronomy, 2(2), 27.
Cao,
Y., Yang, H., Li, J., Zhang, G., Wang, Y., Li, C., & Gao, Y. (2019). Population
development of Frankliniella occidentalis and Thrips hawaiiensis in constant
and fluctuating temperatures. Journal of Applied Entomology, 143(1–2),
49–57.
Castillo,
J. R., Rodríguez Quispe, S. P., Apaza Tapia, W. E., Julca-Otiniano, A. M., Canto
Saenz, M. A., & Rosales Sanchez, T. (2020). Prodiplosis longifila Gagné
(Diptera: Cecidomyiidae) in asparagus (Asparagus officinalis) crop in
Chavimochic Irrigation Project. Peruvian Journal of Agronomy, 4(3),
75.
Cingolani,
M. F., & Greco, N. (2018). Spatio-temporal variation of strawberry aphid
populations and their parasitoids. Applied Entomology and Zoology, 53(2),
205–214.
Cisneros,
F., & Mujica, N. (1998). The leafminer fly in potato: plant reaction and
natural enemies as natural mortality factors. CIP Program Report, 1, 129–140.
Cruces,
L., de la Peña, E., & De Clercq, P. (2020). Insect diversity associated
with quinoa (Chenopodium quinoa Willd.) in three altitudinal production zones
of Peru. International Journal of Tropical Insect Science, 40(4),
955–968.
Cruces,
L. M., Callohuari, Y. T., & Carrera, C. (2016). Quinua: Manejo Integrado de
Plagas. Estrategias en el cultivo de quinua para fortalecer el sistema
agroalimentario en la zona andina. FAO. http://www.fao.org/publications/card/es/c/0336fc7c-a013-410d-9dec-ee8d0d0438f0/
De
Santis, L. (1987). Las especies de Halticoptera (Hymenoptera,
Pteromalidae).pdf. Revista Peruana de Entomología, 28, 1–3.
Dhileepan,
K., Neser, S., Rumiz, D., Raman, A., & Sharma, A. (2017). Host Associations
of gall-Inducing Prodiplosis longifila (Diptera: Cecidomyiidae) from Bolivia:
Implications for its use as a biological control agent for Jatropha
gossypiifolia (Euphorbiaceae). Florida Entomologist, 100(4),
777–786.
Díaz,
W. (1981). Prodiplosis N. sp. (Diptera: Cecidomyiidae) plaga de la alfalfa y
otros cultivos. Revista Peruana de Entomología, 24(1), 95–97.
Duque-Gamboa,
D. N., Castillo-Cárdenas, M. F., Hernández, L. M., Guzmán, Y. C., Manzano, M.
R., & Toro-Perea, N. (2018). The bud midge Prodiplosis floricola in citrus
crops in Colombia. Entomologia Experimentalis et Applicata, 166(3),
204–214.
Filho,
A. M. M., Pirozi, M. R., Borges, J. T. D. S., Pinheiro Sant’Ana, H. M., Chaves,
J. B. P., & Coimbra, J. S. D. R. (2017). Quinoa: Nutritional,
functional, and antinutritional aspects. Critical Reviews in Food Science
and Nutrition, 57(8), 1618–1630.
Gagné,
R. J. (1994). The gall midges of the neotropical region. Cornell
university press, Ithaca.
Healey,
M. A., Brown, P. H., Senior, L. J., & Duff, J. (2017). Relative abundance
and temporal distribution of adult Frankliniella occidentalis (Pergande) and
Frankliniella schultzei (Trybom) on French bean, lettuce, tomato and zucchini
crops in relation to crop age. Journal of Asia-Pacific Entomology, 20(3),
859–865.
Hernández,
R., Fernández, C., & Baptista, P. (2014). Metodología de la
investigación (6th ed.). McGraw-Hill.
Kavallieratos,
N. G., Tomanović, Ž., Starý, P., Žikić, V., &
Petrović-Obradović, O. (2010). Parasitoids (Hymenoptera:
Braconidae: Aphidiinae) Attacking aphids feeding on solanaceae and
cucurbitaceae crops in Southeastern Europe: Aphidiine-aphid-plant associations
and key. Annals
of the Entomological Society of America, 103(2), 153–164.
Korytkowski,
C. (2014). Contribución al conocimiento de los Agromyzidae (Diptera:
Muscomorpha) en el Perú. Rev. Peru. Entomol., 49(1), 1–106.
Leite,
G. L. D., Picanço, M., Zanuncio, J. C., & Ecole, C. C. (2006). Factors
affecting herbivory of Thrips palmi (Thysanoptera: Thripidae) and Aphis
gossypii (Homoptera: Aphididae) on the eggplant (Solanum melongena). Brazilian
Archives of Biology and Technology, 49(3), 361–369.
Liu,
J., Liu, Y., Donkersley, P., Dong, Y., Chen, X., Zang, Y., Xu, P., & Ren,
G. (2019). Preference of the aphid Myzus persicae (Hemiptera: Aphididae) for
tobacco plants at specific stages of potato virus Y infection. Archives of
Virology,
164(6), 1567–1573.
Lopes,
M. C., Farias, E. S., Costa, T. L., Arcanjo, L. P., Santos, A. A., Ribeiro, A.
V, Santos, R. C., & Picanço, M. C. (2019). Economic injury level and
sequential sampling plan for Liriomyza huidobrensis management in tomato crops.
Crop
Protection,
124(June).
MIDAGRI.
(2021). Anuario estadístico de la producción agrícola 2016 y 2019. Sistema
integrado de estadística agraria del Ministerio de desarrollo agrario y riego
del Perú.
Mound,
L. A., & Kibby, G. (1998). Thysanoptera: an identification guide. In Thysanoptera:
an identification guide.
Mound,
L. A., & Kibby, G. (2005). Thysanoptera an identification guide (2nd
ed.). CAB international.
Mujica,
N., & Kroschel, J. (2011). Leafminer fly (Diptera: Agromyzidae) occurrence,
distribution, and parasitoid associations in field and vegetable crops along
the peruvian coast. Environmental Entomology, 40(2), 217–230.
Mujica,
N., & Kroschel, J. (2013). Pest intensity-crop loss relationships for the
leafminer fly Liriomyza huidobrensis (Blanchard) in different potato (Solanum
tuberosum L.) varieties. Crop Protection, 47, 6–16.
Mujica,
Norma, & Kroschel, J. (2019). Ecological, economic, and environmental
assessments of integrated pest management in potato: A case study from the
Cañete Valley, Peru. Food and Energy Security, 8(1), 1–25.
Mujica,
Norma, Sporleder, M., Carhuapoma, P., & Kroschel, J. (2017). A
Temperature-dependent phenology model for Liriomyza huidobrensis (Diptera:
Agromyzidae). Journal of Economic Entomology, 110(3), 1333–1344.
Munroe,
E. (1973). A supposedly cosmopolitan insect: the celery webworm and allies,
genus Nomophila Hubner. The Canadian Entomologist, 105(2), 177–216.
Nazari,
Y., Zamani, A. A., Masoumi, S. M., Rakhshani, E., Petrović-Obradović,
O., Tomanović, S., Starý, P., & Tomanović, Ž. (2012). Diversity and host
associations of aphid parasitoids (Hymenoptera: Braconidae: Aphidiinae) in the
farmlands of western Iran. Acta Entomologica Musei Nationalis Pragae, 52(2),
559–584.
Nielsen,
M. C., Teulon, D. A. J., Chapman, R. B., Butler, R. C., Drayton, G. M., &
Phillipsen, H. (2021). Effects of temperature on survival, oviposition, and
development rate of ‘greenhouse’ and ‘lupin’ strains of western flower thrips,
Frankliniella occidentalis. Entomologia Experimentalis et Applicata, 169(5),
480–490.
Pathan,
S., & Siddiqui, R. A. (2022). Nutritional Composition and Bioactive
Components in Quinoa (Chenopodium quinoa Willd.) Greens: A Review. Nutrients,
14(3), 1–12.
Peck,
O. (1963). A catalogue of the Neartic Chalcidoidea (Insecta: Hymenoptera)
(1st ed.). Entomological Society of Canada.
Raeyat,
Z., Razmjou, J., Naseri, B., Ebadollahi, A., & Krutmuang, P. (2021).
Evaluation of the susceptibility of some eggplant cultivars to green peach
aphid, Myzus persicae (Sulzer) (Hemiptera: Aphididae). Agriculture, 11(1),
1–10.
Rakhshani,
E., Starý, P., Tomanović, Ž., & Mifsud, D. (2015). Aphidiinae
(Hymenoptera, Braconidae) aphid parasitoids of Malta: review and key to
species. Bulletin of the Entomological Society of Malta, 7,
121–137.
Rasmussen,
C., Lagnaoui, A., & Esbjerg, P. (2003). Advances in the knowledge of quinoa
pests. Food
Reviews International,
19(1–2), 61–75.
Redolfi,
I., Palacios, M., & Alcázar, J. (1985). Hymenoptera parasitoides de
Liriomyza huidobrensis en papa cultivada en Rímac, Cañete e Ica. Rev. Peru.
Entomol.,
28, 19–21.
Reitz,
S. R. (2009). Biology and ecology of the western flower thrips (Thysanoptera:
Thripidae): The making of a pest. Florida Entomologist, 92(1),
7–13.
Ren,
X., Wu, S., Xing, Z., Xu, R., Cai, W., & Lei, Z. (2020). Behavioral
responses of western flower thrips (Frankliniella occidentalis) to visual and
olfactory cues at short distances. Insects, 11(3), 1–12.
Rodríguez-Castañeda,
G., MacVean, C., Cardona, C., & Hof, R. (2017). What limits the
distribution of Liriomyza huidobrensis and its congener Liriomyza sativae in
their native niche: When temperature and competition affect species’
distribution range in Guatemala. Journal of Insect Science, 17(4),
1–13.
Rosen,
D., & DeBach, P. (1979). Species of Aphytis of the world (Hymenoptera:
Aphelinidae. Israel Universities Press.
Sánchez,
G. A., & Redolfi, I. (1988). Liriomyza huidobrensis y sus parasitoides en
papa cultivada cultivada en Rímac y Cañete, 1986. Rev. per. Ent., 31, 110–112.
Sarmiento,
J., & Sánchez, G. A. (2012). Evaluación de insectos. Universidad
Nacional Agraria La Molina.
Schmidt,
D., Verruma-Bernardi, M. R., Forti, V. A., & Borges, M. T. M. R. (2021). Quinoa and
Amaranth as Functional Foods: A Review. Food Reviews International,
1–20.
Schmidt,
M. H., Lauer, A., Purtauf, T., Thies, C., Schaefer, M., & Tscharntke, T.
(2003). Relative importance of predators and parasitoids for cereal aphid
control. Proceedings of the Royal Society B: Biological Sciences, 270(1527),
1905–1909.
Soares,
W. S., Plata-Rueda, R. A., Fernandes, M. E. D. S., Fernandes, F. L., Alves, F.
M., & Silva, Í. W. Da. (2019). First record of Liriomyza huidobrensis
(Diptera: Agromyzidae) disseminating Alternaria solani (Pleosporaceae) in
potato crops in Brazil. Florida Entomologist, 102(1), 234–235.
Timothy,
G., & Oseto, C. (2020). Insect collection and identification Techniques
for the field and laboratory. Academic Press.
Trotta,
V., Toma, I., Forlano, P., Fanti, P., Prieto, J. D., & Battaglia, D.
(2021). The age of tomato plants affects the development of Macrosiphum
euphorbiae (Thomas, 1878) (Hemiptera) colonies. Agronomia Colombiana, 39(1),
108–112.
Valarezo,
O., Cañarte, E., Navarrete, B., & Arias, M. (2003). Prodiplosis longifila
(Diptera: Cecidomyiidae) principal plaga del tomate en Ecuador. Instituto
Nacional Autonomo de Investigaciones Agropecuarias, 95.
Velasco-Cuervo,
S. M., Espinosa, L. L., Duque-Gamboa, D. N., Castillo-Cárdenas, M. F.,
Hernández, L. M., Guzmán, Y. C., Manzano, M. R., & Toro-Perea, N. (2016). Barcoding,
population structure, and demographic history of Prodiplosis longifila
associated with the Andes. Entomologia Experimentalis et Applicata, 158(2),
217–227.
Weintraub,
P. G., Scheffer, S. J., Visser, D., Valladares, G., Correa, A. S., Shepard, B.
M., Rauf, A., Murphy, S. T., Mujica, N., MacVean, C., Kroschel, J.,
Kishinevsky, M., Joshi, R. C., Johansen, N. S., Hallett, R. H., Civelek, H. S.,
Chen, B., & Metzler, H. B. (2017). The invasive Liriomyza huidobrensis
(Diptera: Agromyzidae): Understanding its pest status and management globally. Journal
of Insect Science, 17(1), 1–27.
Zamani,
A. A., Talebi, A. A., Fathipour, Y., & Baniameri, V. (2006). Temperature-dependent
functional response of two aphid parasitoids, Aphidius colemani and Aphidius
matricariae (Hymenoptera: Aphidiidae), on the cotton aphid. Journal of Pest
Science, 79(4), 183–188.
Zhou,
H., Yu, T., Chen, L., Li, W., Dong, L., & Sun, S. (2021). Influence of
potato variety and PVY infection on aphid behaviour: Preferences from Myzus
persicae and Macrosiphum euphorbiae. IOP Conference Series: Earth and
Environmental Science, 792, 012041.