Larvas de
invertebrados en el estuario del río Chira, Vichayal, Perú
Invertebrate
larvae in the Chira river estuary, Vichayal, Peru
Isaac David Sandoval Atoche1,
*; Ronald Wilmer Marcial Ramos1
1 Escuela
Profesional de Ciencias Biológicas, Facultad de Ciencias, Universidad Nacional
de Piura.
Urb.
Miraflores S/N, Castilla, Piura, Perú.
*Autor
corresponsal: isaacsandovalato@hotmail.com (I. D. Sandoval
Atoche).
ID
ORCID de los autores
I.
D. Sandoval Atoche:  https://orcid.org/0000-0003-1183-8290 R. W. Marcial Ramos:
https://orcid.org/0000-0003-1183-8290 R. W. Marcial Ramos:
 https://orcid.org/0000-0002-3836-1894
https://orcid.org/0000-0002-3836-1894
RESUMEN
Se determinaron las especies de larvas de
invertebrados presentes en el estuario del río Chira, distrito de Vichayal,
Paita - Piura, la captura se realizó empleando dos artes de larveo artesanal
(Avión y Chayo). Se fijaron 3 estaciones de muestreo (margen derecha, margen
izquierda y entrada principal del estuario). Se obtuvieron 33 muestras de
setiembre 2017 a julio 2018, se reportan 23 larvas de invertebrados que
representan a 22 especies, 16 familias, 5 órdenes y 3 clases y una especie no
determinada perteneciente a la clase Ophiura. Se evaluaron parámetros
fisicoquímicos in-situ, la temperatura ambiente presento una máxima de 26 °C en
febrero y una mínima de 18,2 °C en octubre, la temperatura superficial del agua
presento una máxima en febrero de 26,1 °C y una mínima de 18,5 °C en octubre y la
salinidad varió entre 18 UPS (estación 1) y 5 UPS (estación 3). Los crustáceos
decápodos tuvieron la mayor presencia de larvas de invertebrados del
estuario del río Chira con 78,25 %. La temperatura y salinidad son factores
determinantes de la presencia de las fases larvales de estos organismos en el
estuario.
Palabras
clave:
Temperatura;
salinidad; brachyuros; decápodos; desarrollo larval.
ABSTRACT
The species of invertebrate larvae present in the
Chira River estuary, Vichayal district, Paita - Piura, were determined. The
capture was carried out using two artisanal larval techniques (Avión and
Chayo). 3 sampling stations were established (right bank, left bank and
main entrance of the estuary). 33 samples were obtained from September 2017 to
July 2018, 23 invertebrate larvae are reported, representing 22 species, 16 families,
5 orders and 3 classes and an undetermined species belonging to the Ophiura
class. In-situ physicochemical parameters were evaluated, the ambient
temperature presented a maximum of 26 °C in February and a minimum of 18.2 °C
in October, the surface temperature of the water presented a maximum of 26.1 °C
in February and a minimum of 18.5 °C in October and the salinity varied between
18 UPS (station 1) and 5 UPS (station 3). Decapod crustaceans had the highest
presence of invertebrate larvae from the Chira River estuary with 78.25%.
Temperature and salinity are determining factors for the presence of the larval
stages of these organisms in the estuary.
Keywords: Temperature;
salinity; brachyuros; decapods; larval development.
Recibido: 14-11-2022.
Aceptado: 10-12-2022.

INTRODUCCIÓN
En
Piura encontramos diversos ecosistemas importantes para la conservación de la
biodiversidad, entre ellos los humedales (manglares, estuarios y lagunas)
(Calle, 2013). Los estuarios son ecosistemas caracterizados por la presencia de
una gran diversidad de organismos en diferentes etapas de vida, tales como
hembras ovadas, juveniles, larvas, entre otros (Barletta et al., 2002).
Las
larvas de invertebrados hacen que un ambiente estuarino sea diverso y
productivo, además de ser un eslabón clave en la trama trófica (Virnstein, 1977). Existen algunas investigaciones en
otros estuarios de la región Piura (Barrionuevo & Marcial, 2006; Charcape,
2007; Ríos, 2014; Piscoya & Yupamqui, 2017), pero escasamente se ha
documentado a nivel específico en el estuario del río Chira, especialmente
cuando hablamos de este grupo de organismos que son sensibles a los cambios
ambientales.
La
mayoría de los invertebrados tienen un ciclo de vida indirecto, lo que origina
estados larvales pelágicos que se mantienen en la columna de agua desde unas
horas hasta varios meses antes de asentarse, según la especie, las condiciones
ambientales y el alimento disponible (Scheltema, 1986; Vilicicb et al., 1994;
Buckland et al., 2002; Molinet et al., 2005).
Determinar
y clasificar las larvas en el plancton suele ser un trabajo complicado, en
particular cuando no se conoce la diversidad de la zona de estudio. Esta
carencia de información sobre los estadios larvales, tanto morfológica como
ecológica, está presente en muchos grupos de invertebrados cuyos adultos son
bentónicos y las larvas planctónicas (Albornoz, 1996).
Eventos
anómalos como el “Fenómeno El Niño” en nuestra región, afecta diferentes
recursos produciendo alteraciones en sus procesos biológicos, comportamiento y
una paulatina disminución de sus niveles poblacionales (Estudio Nacional del
Fenómeno El Niño [ENFEN], 2017).
Pero
no solo el estuario del río Chira se ve afectado por eventos meteorológicos,
sino también por las actividades ejercidas por los pobladores de la zona, tales
como pesca artesanal y/o vertimiento de desechos orgánicos e inorgánicos dentro
y fuera del estuario (Céspedes, 2005).
El
estudio de las larvas de invertebrados es de mucha importancia tanto para
contribuir a una mejor comprensión del ciclo de vida de una especie, como por
la información que surge para el interés biológico pesquero (Boltovskoy, 1981).
El
objetivo fue determinar las especies de larvas de invertebrados presentes en el
estuario del río Chira.
El
estuario del río Chira se encuentra ubicado en el distrito de Vichayal,
provincia de Paita, departamento de Piura. Se seleccionaron 3 estaciones de
muestreo, la Estación 1 (bocana), Estación 2 (margen izquierda) y Estación 3
(margen derecha). La ubicación de las estaciones de muestreo en la Figura 1.

Figura 1. Ubicación geográfica de las estaciones de muestreo en
el estuario del río Chira, distrito de Vichayal, Paita -Piura. Fuente Google
Earth.
Las
muestras se colectaron mensualmente de septiembre 2017 a julio 2018, con el método
de larveo artesanal de langostinos propuesto por el Instituto del Mar del Perú
[IMARPE] (2007).
Las
muestras se obtuvieron mediante capturas por 20 minutos, utilizando artes
convencionales para el larveo de langostinos (Fig. A1-a del Anexo ); “Avión”: es
un arte empleado mayormente en las playas, compuesta de una armazón en forma de
“H” con un cono de 2 a 2,5 m de longitud, elaborado con un tul rojo de 1 mm de
abertura; “Chayo” (Fig. A1-b del Anexo), es un instrumento más pequeño,
confeccionado con una tela de tul de las mismas características del “avión”,
pero cuya armazón está compuesta por dos varillas de madera de 1 m de longitud,
que se manipulan a manera de tijera (IMARPE, 2007).
Se
colocaron con cuidado las larvas obtenidas en un recipiente de porcelana con
capacidad de 1 L (Fig. A1-c del Anexo), se separó las larvas de inver-tebrados
de la fauna acompañante (larvas de vertebrados) y de los restos de vegetación transportada
por el rio, luego de obtenida la muestra se colocó en un recipiente de plástico
con capacidad de 1 L y se agregó formol al 4% para su conservación y
posteriormente ser trasladada a laboratorio de Ecología de la Universidad
Nacional de Piura.
Los
parámetros fisicoquímicos fueron medidos in-situ con un termómetro de
mercurio con sensibilidad 0,1 °C, y un refractómetro óptico KOMPASS
(sensibilidad 1‰), se registró la temperatura superficial del agua del
estuario, temperatura del ambiente y salinidad.
Las
larvas se observaron en microscopio y estereoscopio (LABOMED), se determinó su
grupo taxonómico, además de su estadío larval, para su determinación se utilizó
guías y claves taxonómicas como:
“Catálogos
de Zooplancton en el mar peruano” (Santander et al., 1981), “Catálogo de
Crustáceos decápodos y Estomatópodos del Perú” (Moscoso, 2012), “Atlas de
zooplancton del Atlántico Sudoccidental” (Boltovskoy, 1981) parte “III a” y
“III b2”.
“Illustrated
keys for the identi¢cation of the Pleocyemata (Crustacea: Decapoda)” (Santos y
Gonzalez, 2004), “Chave ilustrada para identificação das zoés de Brachyurado
estuário da Lagoa dos Patos (RS) e região costeira adjacente” (Ramos &
Kloetz, 2010), “Morphology of the zoeae larvae of Brachyura
(Crustacea,Decapoda) in Veracruz, southwestern Gulf of Mexico” (Chazaro et al.,
2013).
“Clave
de identificación para los estadios de postlarva y primeros juveniles de
camarón del género Penaeus (Crustacea: Decapoda) Del Golfo De California,
México” (Pérez et al., 1989), “Keys to the larvae of common decapod
crustaceans” (Weiss, 2017), “Marine Zooplankton Practical Guide” (Yamani et
al., 2011), y trabajos individuales como: Medellín et al. (2009); Cuesta &
Gordillo (2020); Haug et al. (2016); Cházaro et al. (2017); Ferrández (2017); Ocaña
& Pérez (2004); Mujica et al. (2015); Dworschak et al. (2012) y Harvey et
al. (2014).
Se determinaron 22 especies
repartidos en 16 familias (Tabla 1). Además, se observó la presencia de una
larva Ophioploteus no determinada perteneciente a la orden Ophiurida.
Tabla 1
Clasificación de larvas de
invertebrados encontradas en las tres estaciones de muestreo en el estuario del
río Chira
|
Familia
|
Género / Especie
|
|
Penaeidae
|
Penaeus vannamei
|
|
Penaeus californiensis
|
|
Penaeus stylirostris
|
|
Penaeus brevirostris
|
|
Palaeomonidae
|
Palaeomon sp.
|
|
Callianassidae
|
Callianassa sp.
|
|
Callichirus sp.
|
|
Diogenidae
|
Paguristes sp.
|
|
Dardanus sp.
|
|
Hippidae
|
Emerita analoga
|
|
Albuneidae
|
Lepidopa sp.
|
|
Portunidae
|
Callinectes sp.
|
|
Uca sp.
|
|
Sesarmidae
|
Aratus pisonii
|
|
Grapsidae
|
Pachygrapsus sp.
|
|
Varunidae
|
Cyclopgrapsus sp.
|
|
Pinnotheridae
|
Pinnixa sp.
|
|
Panopeidae
|
Panopeus sp.
|
|
Squillidae
|
Squilla sp.
|
|
Euphausiidae
|
Euphausia sp.
|
|
Caligidae
|
Caligus sp.
|
|
Oikopleuridae
|
Oikopleura sp.
|
|
Orden
|
|
|
Ophiurida
|
No Determinada
|
Se encontró más de un estadio larval en
algunas especies de invertebrados en el estuario del río Chira, el reconocer
las fases de desarrollo además de necesario fue útil, porque facilitó su
clasificación y posterior determinación, coincidiendo con lo mencionado por
(Costlow & Bookhout, 1968; Mcconnaughey, 1974; Ruppert & Barnes, 1996).
El estuario del río Chira presentó 20
especies de larvas de crustáceos, repartidas en 14 familias. Este tipo de
ecosistemas en la región Piura muestran una semejanza en la cantidad de
crustáceos encontrados; así Barrionuevo & Marcial (2006) registraron 14
especies de crustáceos distribuidas en 9 géneros y 8 familias en los Manglares
de San Pedro-Piura, también hallaron 7 estadios larvarios entre crustáceos e
insectos; Charcape (2007) reporta en el manglar “San Pedro” de Vice 23 especies
de crustáceos.
En el estuario del río Chira el 78,25% de
las larvas de invertebrados registradas corresponde a los decápodos, agrupados
en 12 familias. Siendo este taxón el más abundante con un total 18 especies, seguido
de 5 órdenes que representan el 4,35% cada uno (Figura 2).
Ríos (2014), en el estuario de Virrila –
Sechura determinó larvas de 2 bryozoos, un poliqueto, 7 crustáceos, de los
cuales 6 fueron copépodos en estado adulto y nauplios. Piscoya y Yupanqui
(2017), determinaron 7 larvas del zooplancton en el manglar de San Pedro -
Piura: cirrípedo, bivalvo, crustáceo, nauplio de copépodo, larva de poliqueto,
larva trocófora y una de Chironomidae. En las muestras del estuario del rio Chira
se encontró larvas de decápodos, copépodos, apendicularia y Ophiura.
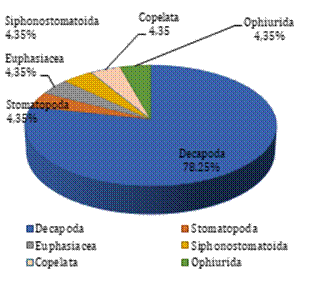
Figura 2. Distribución
porcentual por órdenes de las larvas en las tres estaciones de muestreo en el
estuario del río Chira.
Cabe destacar que el orden Decápoda con 5
infraordenes (Penaeoidea, Caridea, Axiidea, Anomura y Brachyura) fue el más
representativo en el estuario del río Chira. Comparado con lo encontrado en
otras regiones nuestra data se asemeja a lo reportado por Cervellini (2001) al
determinar 30 especies de larvas de crustáceos en el estuario de Bahía Blanca,
Argentina, clasificados en 15 familias y 4 infraordenes (Caridea, Thalassinidea,
Anomura y Brachyura).
En el infraorden Brachyura se registró 6
familias: Portunidae, Sesarmidae, Grapsidae, Varunidae, Pinnotheridae y
Panopeidae, esto muestra una cantidad mayor de familias a diferencia de lo
encontrado por IMARPE (2007) en la bahía de Sechura frente a la bocana de San
Pedro (estuario de San Pedro), donde encontró familias como Majidae, Grapsidae,
Porcellanidae.
Los resultados correspondientes a la
temperatura superficial del estuario (°C) se muestran en la Figura 3, el valor
máximo se presentó en la estación 1 con 26,1 °C en marzo del 2018 y el valor
mínimo correspondió a 18,0 °C en la estación 2 en octubre 2017.
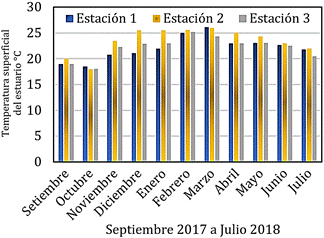
Figura 3. Variación de
la temperatura superficial del estuario (°C) de las tres estaciones, setiembre
2017 a julio 2018.
La temperatura ambiente (°C) se muestra en
el Figura 4, el valor máximo registrado fue 27,3°C en marzo 2018 en la estación
2 y el menor valor fue de 18,2 °C en octubre 2017 en la estación 1.
Benfield (2013), menciona que la temperatura
puede influenciar en desarrollo, comportamiento y metabolismo de las larvas
estuarinas.

Figura 4. Temperatura
ambiente registrada en cada estación del estuario del río Chira.
La salinidad en la estación 1 oscilo entre
16– 20 (UPS), los cambios observados en los niveles de salinidad están asociado
con la presencia de larvas en esta estación, dado que existen muchas especies
que son tolerantes a ciertos rangos de salinidad (Benfield, 2013). En la
estación 2 los valores de salinidad estuvieron entre 13 – 20 (UPS). Los mayores
cambios de salinidad se observaron en la estación 3, llegando la salinidad a
bajar hasta los 5 (UPS) en marzo y con un punto más alto de 16 (UPS) en octubre
(Figura 5).
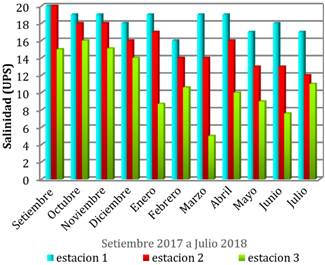
Figura 5. Variación de
la salinidad según estación en el estuario del río Chira, setiembre- diciembre
2017 a enero- julio 2018.
Se observó que entre diciembre 2017 a marzo
2018 en la estación 1, la salinidad fluctuó entre 16 – 19 (UPS), la temperatura
superficial del estuario fue >21 °C y < 26,1 °C y la temperatura ambiente
fue >22 °C y < 26 °C, condiciones donde se hallaron las cuatro especies
de peneidos (P. stilylirostris, P. vannamei, P. californiensis
y P. brevirostris) lo cual tiene relación con lo mencionado por Piccolo &
Perillo (1997) al indicar que las larvas y postlarvas de los camarones Caridea
y Penaeoidea se registraron en la desembocadura donde los factores abióticos,
fundamentalmente la salinidad son más constantes. Por otra parte, García (1976)
menciona que la etapa reproductiva en peneidos (L. stylirostris) en el
medio natural está asociada estrictamente con la temperatura.
Sin embargo, para Ramírez &
Aragón (2006) tras estudiar el hábitat de las postlarvas de los camarones
peneidos que ingresan al estuario del río Colorado, muestran que las postlarvas
de camarón azul P. stylirostris y camarón café P. californiensis
son más abundantes en mayo, junio y septiembre (estación de verano); coincidiendo
con nuestro registro, las postlarvas de los peneidos se presentaron desde
octubre 2017 a marzo 2018, con mayor presencia en los meses de verano.
Entre los portunidos registrados,
Callinectes sp. se encontró en la Estación 1 entre marzo a mayo con
salinidad 17 – 19 (UPS) y el género Uca en la Estación 2 con salinidad
de 13-16 (UPS). La información obtenida se ve apoyada por lo registrado por
Estrada (1999) y Ramírez et al. (2003) al mencionar que los portunidos se
desarrollan en salinidades de al menos 20 partes por mil, y que en algunas
especies de Callinectes son tolerantes a bajas salinidades.
También se registró un copépodo del género Caligus
en la estación 1, se observó en diferentes etapas de desarrollo, en su fase
larval (Chalimus), con temperatura superficial del estuario >20 °C y
≤26,1 °C y salinidad entre 16 - 19 UPS. González y Carvajal (1999)
comprobaron que la salinidad afecta el desarrollo de las larvas, observaron que
los nauplius no mudan a copepodito a salinidades iguales o inferiores a 15 ppm;
después en 2003, describen que este copépodo en su ciclo de vida depende
directamente de la temperatura del agua.
En efecto, en la desembocadura (estación 1)
del estuario del rio Chira y/o lugares más próximos a éste, es donde se
presentó el mayor número de géneros, coincidiendo con lo mencionado por Mujica &
Medina (2000) al referirse que el número de especies aumento en zonas próximas
al mar.
En un contexto general, se observó que al
aumentar la temperatura ambiental y del estuario en los meses de verano, hubo
un incremento importante del número de especies registradas, por lo que este
parámetro resulta determinante para el desarrollo de los ciclos reproductivos y
por ende de las fases larvales de diversas especies.
En relación al gradiente de salinidad las
zonas que presentaron menores variaciones posibilitaron el desarrollo de más
especies de larvas, por ello presentaron los valores más altos. Esto favoreció
la presencia de las larvas de invertebrados en el estuario del rio Chira, donde
se determinaron 22 larvas a nivel de especie y una a nivel de orden.
Se determinaron 22 especies
de larvas de invertebrados, distribuidas en 16 familias, además de 1 especie
del orden Ophiurida en el estuario del río Chira, distrito de Vichayal, Paita
-Piura.
El 78,25 % de larvas de
invertebrados del estuario del río Chira fueron crustáceos decápodos,
pertenecientes a 5 infraórdenes y 12 familias, siendo el infraorden Brachyura
el más numeroso con 7 géneros.
La mayor presencia de
larvas de invertebrados se registró en febrero en la estación 1 (bocana), con
temperatura superficial del estuario de 25 °C, temperatura ambiente 26 °C y
salinidad 16 UPS.
Los gradientes de
temperatura superficial y salinidad del estuario fueron determinantes en la
presencia de las larvas de invertebrados.
Los registros obtenidos
servirán como base para realizar nuevas investigaciones que permitan conocer el
estado de sus poblaciones, además de que se pueda considerar en evaluar más
factores fisicoquímicos y/o si las diferentes actividades humanas estarían
afectando o fragmentando la composición de la flora y fauna acuática del
estuario, cuya información ayudaría a una mejor comprensión, conservación y
aprovechamiento de este ecosistema.
Agradecemos al
Departamento Académico de Ciencias Biológicas de la Universidad Nacional de Piura
por el préstamo de los materiales y equipos para la determinación de las
especies durante la investigación y al comité editorial de la revista Manglar
por sus aportes que permitieron mejoras en el artículo.
REFERENCIAS
BIBLIOGRÁFICAS
Albornoz, L. (1996).
Desarrollo morfológico en larvas de Nauticaris magellanica (A.M. Edwards, 1891)
(Decapoda: Caridea: Hippolytidae), una comparación laboratorio-plancton. Tesis,
Esc. de Biología Marina, Fac. de Ciencias, Univ. Austral de Chile, Valdivia,
104 pp.
Barletta, A., Barletta, M.,
& Saint, U. (2002). Structure and seasonal dynamics of larval fish in the
Caeté River in north Brazil. Est. Coast. Shelf Sci., 154, 193-206.
Barrionuevo, R., &
Marcial, R. (2006). Ecología trófica de la fauna acuática en el manglar de San
Pedro – Sechura. Departamento Académico de ciencias. Universidad Nacional de
Piura.
Benfield, M. C. (2013). Estuarine
zooplankton. Chap 11. In Estuarine ecology, 2nd edition. Day J. W., B.C. Crump,
W. M. Kemp, and A. Yáñez-Arancibia, editors. John Wiley & Sons, Inc,
New Jersey, U.S. ISBN 978-0-471-75567-8.
Boltovskoy, D. (1981). Atlas de
Zooplancton del Atlántico sudoccidental y métodos de trabajo con el zooplancton
marino. Publicación especial. Instituto Nacional de Investigación y desarrollo
Pesquero – INIDEP, Mar de Plata, Argentina. 936 p.
Buckland N. J., Gibson, G.,
& Koss, R. (2002). Phylum Mollusca: Gastropoda. En: Young C.M. (ed.). Atlas
of Marine Invertebrate Larvae. Academic Press, California, cap. 14: 261-287.
Calle, C.
(2013). Diagnostico Socio Económico y Ambiental de la Zona Marino Costera de la
Provincia de Paita. FODA. Gobierno Regional de Piura (GORE PIURA).
Cervellini, P. (2001).
Variabilidad en la abundancia y retención de larvas de crustáceos decápodos en
el estuario de Bahía Blanca, Provincia de Buenos Aires, Argentina. Invest.
Mar Valparaíso, 29(2), 25-33, 2001.
Céspedes, C.
(2005). Análisis de amenazas del estuario de Virrilá. Proyecto: Plan de Manejo
Participativo del Estuario de Virrilá. Lima, Perú: Asociación Perú Verde y
Comité Holandés de la IUCN 80 p.
Charcape, J. (2007).
Evaluación y valoración económica ambiental del manglar “San Pedro” de Vice,
Sechura – Piura – Perú. Tesis Doctoral. Universidad nacional de Trujillo,
Escuela de postgrado.
Cházaro, O., Ortiz, T.,
Winfield, I., Robles, F., & Torres, D. (2017). Morphology of stomatopod
larvae from National Parks: Sistema Arrecifal Veracruzano and Arrecife Puerto
Morelos, Mexico. e-ISSN 2358-2936.
Cházaro, O., Winfield, I.,
Ortiz, T., Cházaro, M., Vázquez, L., & Horta, P. (2013). Morphology of
the Zoeae Larvae of Brachyura (Crustacea, Decapoda) in Veracruz, Southwestern
Gulf of Mexico. American Journal of Life Sciences, 1(5), 238-242.
Costlow, Jr., &
Bookhout, C. G. (1968). The complete larval development of the land-crab, Cardisoma
guanhumi Latreille in the laboratory (Brachyura, Gecarcinidae). Crustaceana, Leiden. Suppl.
2, 259-270.
Cuesta, J., & Gordillo,
J. (2020). Varunidae H. Milne-Edwards, 1853, and Ocypodidae Rafinesque, 1815. ICES
Identification Leaflets for Plankton No. 190. 19 pp.
Dworschak, P., Felder, D., &
Tudge, C. (2012). Infraorders Axiidea de Saint Laurent, 1979 and Gebiidea de Saint
Laurent,1979 (Formely known collecctivelly as Thallasinidea). Vol 9. Part B.
Estrada, V. A. (1999).
Aspectos poblacionales de la jaiba Callinectes arcuatus Ordway 1863, en
la laguna de Coyutlán, Colima, México. Tesis de Maestría. Facultad de Medicina Veterinaria
y Zootecnia. Universidad de Colima, México. 77p.
Estudio Nacional del
Fenómeno “El Niño” - ENFEN, (2017). Informe Técnico Extraordinario
N°001-2017/ENFEN EL NIÑO COSTERO 2017. Comisión multisectorial encargada del
estudio nacional del fenómeno “EL NIÑO” – ENFEN. Decreto Supremo N°
007-2017-PRODUCE.
Ferrández, A. (2017). Un
día en la vida de un laboratorio de Oikopleura. Public. https://thenode.biologists.com/day-life-oikopleura-lab/lablife/
García, G. M. (1976).
Fecundidad del camarón café Penaeus californiensis y del camaron azul Penaeus
stylirostris Puerto Peñasco y Guaymas, Sonora. Memorias del Simposio sobre
biología y Dinámica Poblacional de Camarones S.I.C. Subsecretaria de Pesca
Instituto Nacional de Pesca. Tomo 1. 131-139.
González, L., & Carvajal,
J. (2003) Life cycle of Caligus rogercresseyi (Copepoda: Caligidae)
parasite of Chilean salmonids. Aquaculture, 220, 101-117.
González, L., &
Carvajal, J. (1999). Identificación de especies de calígidos, descripción del
ciclo de vida y factores abióticos que determinan su presencia. Pág. 1-79. En
L. Hidalgo y J. Cassigoli, editores. Estrategias y medidas de manejo en la
producción intensiva de salmónidos, para el control del Síndrome Rickettsial
(SRS) y el parasitismo producido por el Caligus, en las regiones X a XII de
Chile. Informe Final Proyecto FONSIP L1PP01. INTESAL-Instituto de Fomento
Pesquero-Universidad de Chile-Universidad de Los Lagos. Puerto Montt,
Chile.
Harvey, A., Boyko, C., MC
Laughlin, P., & Martin, W. (2014). Infraorder Anomura. Pp: 283-294. In
book: Atlas of Crustacean Larvae. Publisher: Johns Hopkins University Press. Editors:
J. W. Martin, J. Olesen, J. Høeg.
Haug, C., Shane, T.,
Wiethase, H., Olesen, J., & Haug, J. (2016). Extreme morphologies of mantis shrimp
larvae. e-ISSN 2358-2936.
Instituto del mar del Perú
– IMARPE. (2007). Estudio de línea base del ámbito marino de la bahía de
Sechura. Inst. Mar del Perú. Pp 1-116.
Instituto del mar del Perú
– IMARPE. (2007). Monitoreo de postlarvas de langostinos en tumbes, Perú 1993
-2003. Informe N 4, Vol.34. ISSN: 0378-7702.
Mcconnaughey, H. B. (1974).
Introducción a la biología marina. Acribia. Zaragoza, España. Pp 7-8, 103 -
104, 132 - 136.
Medellín, J., Campos, N.,
Herrera, A., & Jaimes, J. (2009). Taxonomía de larvas Zoea de Crustáceos
decápodos del área nororiental del mar Caribe Colombiano. Bol. Invest. mar
Cost. 38(2), 55 – 73.
Molinet, C., Arévalo, A.,
González, M., Moreno, C., Arata, J., & Niklischek, E. (2005). Patterns of
larval distribution and settlement of Concholepas concholepas (Bruguiere, 1789)
(Gastropoda: Muricidae) in fjords and channels of southern Chile. Rev. Chil. Hist. Nat. 78, 409-423.
Moscoso, V. (2012).
Catálogo de crustáceos decápodos y estomatópodos del Perú. Boletín Instituto
del Mar del Perú. 27(1-2). ISSN 0458 – 7766.
Mujica, A., Nava, L., &
Flores, E. (2015). Descripción del estado de megalopa de Emerita analoga
(Stimpson, 1857) (Decapoda, Anomura, Hippidae). Lat. Am. J. Aquat. Res., 43(1),
262-266.
Mujica, A., & Medina,
G. (2000). Distribución y abundancia de larvas de crustáceos decápodos en el
zooplancton de los canales australes. Cienc. Tecnol. Mar, 23, 49-68.
Ocaña, A., & Pérez, A.
(2004). Los Equinodermos de las costas andaluzas. Acta Granatense, 3,
83-136.
Pérez, J., Regalado, E., &
Rodríguez, S. (1989). Clave de identificación para los estadíos de postlarva y
primeros juveniles de camarón del género Penueus (Crustacea: Decapoda) del
Golfo de California, México. Ciencias Marinas, 15(3), 57-70.
Piccolo, M. C., &
Perillo, M. E. (1997). Geomorfología e hidrografía de los estuarios. En: E. E.
Boschi (ed.). El Mar Argentino y sus Recursos pesqueros. Tomo 1. Instituto
Nacional de Investigación y Desarrollo Pesquero, Mar del Plata. Argentina, pp.
133-161.
Piscoya, C., &
Yupanqui, A. (2017). Composición específica, diversidad, distribución y
variación espacio – temporal del fitoplancton, Zooplancton y macrozoobentos en
el ecosistema del manglar del San Pedro, Vice, Piura. Noviembre 2014 – octubre
2015. Tesis, Universidad Nacional Pedro Ruiz Gallo. Facultad de Ciencias
Biológicas Departamento académico de Pesquería y zoología.
Ramírez, A., & Aragón,
E. (2006). Ecología de postlarvas de camarón azul (Litopenaeus stylirostris)
y camarón café (Farfantepenaeus californiensis) en el Estuario del Río
Colorado. Nota de Investigación. Ciencias Marinas, 32(1A), 45–52.
Ramírez, F. E., Singh, C.,
Gil, L., Sarmiento, N., Salazar, N., Montemayor, L., García, B., Rodríguez, D.,
& Castañeda, L. (2003). La Pesquería de Jaiba (Callinectes spp.) en
el Pacífico Mexicano: Diagnóstico y Propuesta de Regulación. SAGARPA, INP.
Mazatlán, Sinaloa, septiembre de 2003. 54p.
Ramos, R., & Kloetz, D.
(2010). Chave
ilustrada para identificação das zoés de Brachyura do estuário da Lagoa dos
Patos (RS) e região costeira adjacente. Biota Neotrop. 10(3), 431-437.
Ríos, S. (2014). Ecología
trófica de la fauna acuática del estuario de Virrila – Sechura. Tesis de Grado.
Universidad Nacional de Piura. Escuela de Biología.
Ruppert, & Barnes,
(1996). Zoología de los invertebrados. 6ed. Mc Graw-Hill Interamericana
Editores S.A. de C.V. ISBN: 968-25-2452-0.
Santander, H., Luyo, G.,
Carrasco, S., Véliz, M., & O.S. De Castillo, (1981). Catálogo de
Zooplancton en el Mar Peruano, Primera parte: Área Pisco-San Juan. Boletín
Instituto del Mar del Perú.
Santos, A., & Gonzales,
A. (2004). Illustrated
keys for the identication of the Pleocyemata (Crustacea: Decapoda) zoeal
stages, from the coastal region of south-western Europe. Mar. Biol. Ass.
U.K., 84, 205-227.
Scheltema, R. (1986). On
dispersal and planktonic larvae of marine invertebrates: an eclectic overview
and summary of problems. Bull. Mar. Sci. 39, 290-322.
Vilicic, D., Musin, D., &
Jasprica, N. (1994). Interrelations between hydrographic conditions,
nanoplankton and bivalve larvae in the Mali Ston Bay (Southern Adriatic). Acta
Adriatica, 34(1-2), 55-64.
Virnstein, R. W. (1977).
The importance of predation by crabs and fishes on benthic infauna in
Chesapeake Bay. Ecology, 58, 199-217.
Weiss, H. (2017). Keys to
the Larvae of common Decapod Crustacean. Proyect Oceanology 1084 Shennecossett
Rd. Groton CT 06340. Connecticut Sea Grant University of Connecticut. CTSG-17-09.
Yamani, Y., Skryabin, V.,
Gubanova, A., Khvorov, S., & Prusova, I. (2011). Marine Zooplankton
Practical Guide for the Northwestern Arabian Gulf. Vol2. Published in Kuwait in
2011 by Kuwait Institute for Scientific Research, ISBN 978-99966-95-07-0.
Anexos

Figura A1. Vistas de la
toma de muestra, parámetros fisicoquímicos y georreferenciación durante los
muestreos.
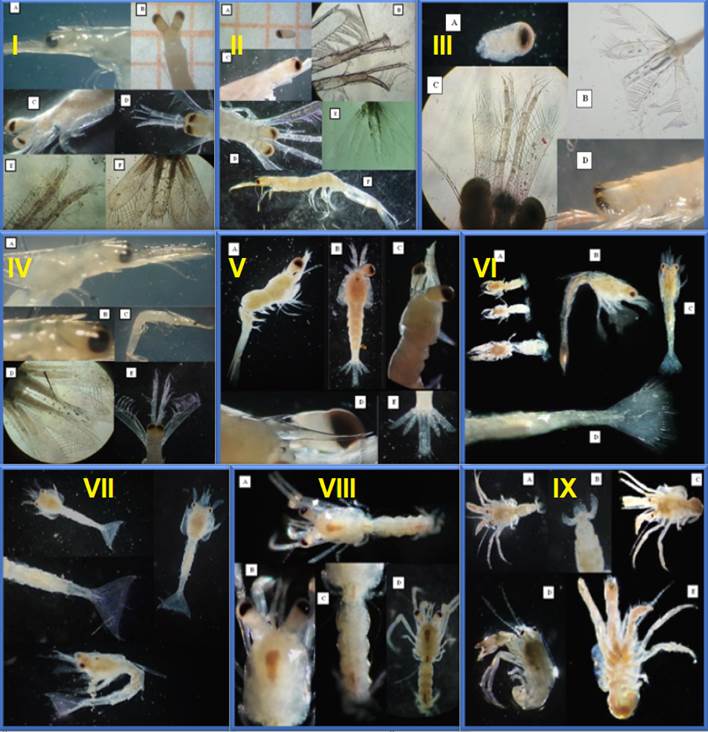
Figura A2. Vistas de las
secciones utilizadas para la determinación de las especies de larvas de
invertebrados registradas en el estuario del río Chira. I Penaeus vannamei, II Penaeus californiensis, III Penaeus
stylirostris, IV Penaeus brevirostris, V Paleomon sp, VI Callianassa sp, VII Callichirus sp, VIII Paguristes sp, IX Dardanus sp.
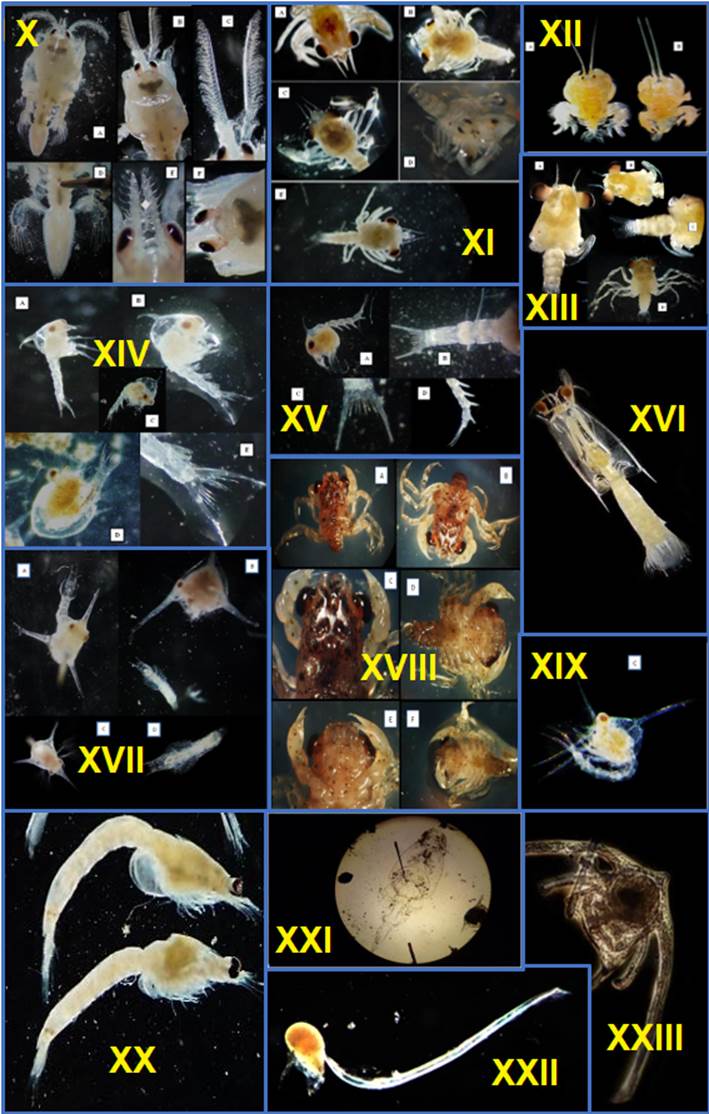
Figura A3. Vistas de las
secciones utilizadas para la determinación de las especies de larvas de
invertebrados registradas en el estuario del río Chira. X Emerita analoga,
XI Callinectes sp, XII Lepidopa sp, XIII Pachygrapsus sp,
XIV Uca sp, XV Aratus pisonii, XVI Squilla sp, XVII Pinnixa
sp., XVIII Cyclopgrapsus sp. XIX Panopeus sp, XX Euphausia
sp, XXI Caligus sp, XXII Oikopleura sp y XXIII Larva Ophiurida.
![]() https://orcid.org/0000-0003-1183-8290 R. W. Marcial Ramos:
https://orcid.org/0000-0003-1183-8290 R. W. Marcial Ramos:
![]() https://orcid.org/0000-0002-3836-1894
https://orcid.org/0000-0002-3836-1894







