Crecimiento in vitro de
Conchocelis, Pyropia sp. sobre sustrato artificial con diferentes fertilizantes comerciales
In vitro growth of
Conchocelis, Pyropia sp. on artificial substrate with different commercial fertilizers
Guido
Gerónimo Maldonado 1, *; Wilfredo Celestino Baldeón Quispe2; Orlando
Advíncula Zeballos3
1 Laboratorio de CEMTRAR (BIOFACTORIA), Facultad
de Ciencia, Universidad Nacional Agraria La Molina, Lima, Perú.
2
Departamento de Ingeniería
Ambiental, Laboratorio de CEMTRAR (BIOFACTORIA), Facultad de Ciencias,
Universidad Nacional Agraria La Molina, Lima, Perú.
3
Facultad de Ingeniería Ambiental, Universidad San Ignacio
de Loyola, La Molina, Lima, Perú.
*Autor corresponsal: gmaldonado@lamolina.edu.pe (G. Gerónimo Maldonado).
ID ORCID de los autores
G. Gerónimo
Maldonado: http://orcid.org/0000-0003-1910-2851 W. C. Baldeón
Quispe: http://orcid.org/0000-0003-1937-534X
O. Advíncula Zeballos: http://orcid.org/0000-0003-2042-7872
RESUMEN
Las
industrias acuícolas han crecido recientemente, pero todavía hace falta
información sobre las técnicas de cultivo
para las primeras etapas de la vida de Pyropia sp. (Rhodophyta). Esta
investigación tuvo como objetivo determinar
la concentración óptima de fuentes comerciales de nutrientes esenciales de la
marca Bayfolan® y solución
hidropónica La Molina® A y B, para el crecimiento y desarrollo de la fase
“conchocelis” de Pyropia. La fase
se investigó en condiciones de temperatura de 15,03 ±0,31 °C, salinidad 36,05
±0,23 PSU, conductividad eléctrica 55,95 ± 0,14 mS/cm, irradiancia 15,93 ±0,03 µmol m-2 s-1 y fueron sometidos a diferentes tratamientos y control con fertilizantes Bayfolan y solución hidropónica A y
B La Molina. Asimismo, los resultados obtenidos fueron la absorción máxima Nitrato con fertilizante Bayfolan®
y Solución Hidropónica La Molina con de 0,1465
mM y 1,369 mM y de Fosfato
presentando una absorción máxima 0,0312 mM y 0,053
mM, respectivamente. Los experimentos
fueron evaluados en una cámara de germinación LED (TE-4020 Tecnal) programada
por un intervalo de tiempo de 800
horas de asentamiento de Cigotospora para su crecimiento a conchocelis; además, la comparación de medias se la realizo
mediante un test de Tukey con un valor de p ≥ 0,05, obteniéndose un crecimiento sobre el sustrato
de 4,15 mm2 con la solución la Molina y 1,54 mm2 con la Solución Bayfolan®, pero con
diferente cobertura de conchocelis sobre el sustrato 49,75% y 63,09%. Dejando
como evidencia que, el crecimiento de
“Conchocelis” es cultivado in vitro con fertilizantes comerciales, estrategia
para una industria sostenible de “nori”
en Perú.
Palabras clave: Esporofito; Porphyra sp.;
Absorción de minerales; asentamiento
ABSTRACT
Aquaculture industries have grown recently,
but there is still a lack of information on culture techniques for the early life stages of Pyropia sp.
(Rhodophyta). This research aimed to determine the optimum concentration of Bayfolan® brand commercial sources of
essential nutrients and La Molina® A and B hydroponic solution, for the growth and development of the "conchocelis" stage of Pyropia. The phase was investigated under conditions of temperature 15.03 ±0.31 °C, salinity 36.05 ±0.23 PSU, electrical conductivity 55.95 ± 0.14 mS/cm, irradiance
15.93 ±0.03 µmol m-2 s-1 and subjected to different treatments and control with Bayfolan®
fertilizers and hydroponic solution A
and B La Molina. Likewise, the results obtained were the maximum Nitrate uptake
with Bayfolan® fertilizer and La Molina Hydroponic Solution with 0.1465 mM and 1.369 mM and Phosphate
presenting a maximum uptake 0.0312 mM and 0.053 mM, respectively. The
experiments were evaluated in a LED
germination chamber (TE-4020 Tecnal) programmed for a time interval of 800
hours of settlement of Cigotospora
for its growth to conchocelis; in addition, the comparison of means was
performed by a Tukey test with a
value of p ≥ 0.05, obtaining a growth on the substrate of 4.15 mm2 with the La Molina solution and 1.54 mm2 with the Bayfolan® Solution, but with different coverage of conchocelis on the substrate
49.75% y 63.09%.
Leaving as evidence
that the growth
of "Conchocelis" is cultivated in vitro with commercial fertilizers, a strategy for a sustainable industry
of "nori" in Peru.
|
|
 |
Keywords: Sporophyte;
Porphyra sp.; mineral
absorption; settlement.
Recibido: 10-08-2022.
Aceptado: 21-11-2022.
Esta obra está publicada bajo la licencia CC BY 4.0
A
nivel mundial las tres algas marinas de mayor
producción acuícola para el consumo
humano directo son: Laminaria
japónica (kombu), Undaria pinnatifida
(wakame) y Porphyra sp. (nori); siendo
el género Porphyra el que presenta
la mayor producción en la maricultura japonesa y un
mayor valor económico a comparación del kombu y el wakame (McHugh, 2002; FAO, 2016).
Además, se caracteriza por su gran riqueza en proteínas, mucilagos, oligoelementos y vitaminas, por
lo que existe un elevado
aprovechamiento de las algas en la alimentación humana (Aragón et al., 2012). Específicamente,
sus propiedades se han atribuido a distintos
compuestos bioactivos: polisacáridos sulfatados, polifenoles, carotenoides, aminoácidos, proteínas/péptidos y lípidos (Mohamed
et al., 2012).
El talo de Porphyra sp. es de color verde olivo, marrón
rojizo o marrón.
Los individuos monoicos
o dioicos presentan el soro
reproductivo marginal o disperso, a
veces confinado a distintos sectores del folio.
El soro masculino está formado por paquetes
de espermatangios y el femenino
por gametos a
menudo con tricomas conspicuos. Cada gameto femenino
después de la fertilización forma paquetes de 8 a 16 cigotosporangios (Sutherland et al.,
2011; Guiry &
Guiry, 2018).
En el Perú, las algas marinas
son exportadas y utilizadas
como materia prima en la industria de alginatos,
carragenanos y agar; también se utilizan para consumo
humano directo y para la elaboración de productos de aseo personal
(Vivanco et al., 2011; Aragón et al., 2012). Además, otro uso que se le da es en forma de
polvo seco como aditivo para la
alimentación animal o como fertilizantes agrícolas (FAO, 2016).
En base a lo antes expuesto, se desarrolló el crecimiento
de las macroalgas Porphyra sp. en su etapa
conchocelis y para llevarlas en un futuro a la
maricultura; evaluando el efecto con diferentes nutrientes (fertilizantes) en la etapa
microscópica llamada conchocelis.
Se tuvo como objetivo determinar el efecto de los nutrientes comerciales óptimos como fuente de nitrógeno
y fósforo (Nitrato y Fosfato de Bayfolan® y de
solución hidropónica La Molina.
Lugar de ejecución
MATERIAL Y MÉTODOS
a través de una lámpara que expuso el agua a la
Las muestras se recolectaron en la playa Santa Elena ubicada en la Bahía de Paracas
(13°49′36″S; 76°16′22″O)
en la provincia de Pisco, región Ica, Perú.
Para después transportarlas al Laboratorio de Biofactoria ubicado en el Centro Modelo de Tratamientos Residuos (CEMTRAR) de la Universidad Nacional Agraria La Molina
(UNALM), Lima, Perú, en
contenedores térmicos aislados en frío
(tipo cooler) para evitar el estrés térmico o
radiación solar en el transporte.
Recolección de las muestras
Se colectó frondas
fértiles de Pyropia sp. con coloración rojiza en los márgenes
del talo en la playa Santa
Elena ubicada en la Bahía
de Paracas.
Medición del área Convexa del Bivalvo
Las conchas enteras fueron lavadas con detergente, luego,
se determinó el área convexa
de la superficie de la valva con el software
FIJI-ImageJ que, mediante fotografías tomadas a todas las
valvas a una altura de 20 cm, se pudo
determinar el área de cada una de ellas para saber la cobertura
de crecimiento.
Esterilización del agua de mar
Para lograr el proceso de esterilización del agua de mar se
llevaron a cabo cuatro etapas.
Primera etapa
Se subdividió en dos momentos:
el proceso de filtración y la esterilización mediante rayos ultravioleta (UV). La filtración se llevó
a cabo con un sistema RAS mediante
3 cartuchos de filtro hilado (1,5
y 10 micras, MY-RO50E) de polipro- pilenos
por 24 horas para retener los sólidos que provienen
del mar y así evitar su interferencia con el
láser del fotocolorímetro (YPT 9500). Seguida-
mente, se procedió
a la esterilización mediante UV
radiación UV para destruir cualquier microorga- nismo remanente.
Segunda etapa
Cloración, donde el agua se sometió a una segunda esterilización, esta vez por cloro. Se agregaron 2 mL de cloro líquido por L de agua de mar,
para ser aireada por al menos 24 h, al terminar
este proceso se procedió a titular el agua con una
solución 2 mL de tiosulfato para liberar el agua del cloro, se agregaron
2 mL de solución de tiosulfato 0,498 M por
litro de agua clorada. Para preparar la solución de tiosulfato se agregaron 10 g de
tiosulfato de sodio en 100 mL de agua destilada para
luego de agregar la solución de
tiosulfato al agua clorada, se corroboró
que no haya cloro disuelto en el agua de mar
con un kit de cloro para evaluar la presencia o ausencia de cloro.
Tercera etapa
Se procedió a esterilizar en autoclave, una vez corroborada la ausencia de cloro, el agua fue vertida en vasos precipitado de 500 ml con su respectiva
concha de abanico (A. purpuratus), al
fondo de cada vaso precipitado con posición convexa hacia arriba y cubrió la totalidad de la base para
tener mayor área de asentamiento disponible
por las cigotosporas. Una vez colocada el agua y la valva se sometieron a la autoclave por 25 min a 121
°C. Al culminar el tiempo se dejó enfriar por 2 h para agregar los nutrientes comerciales
Bayfolan® con
diferentes proporciones 25%, 50% y 100% y solución hidropónica La Molina, soluciones concentradas A y B a diferentes proporciones ya mencionadas. Cada vaso precipitado fue
rotulado con las diferentes
proporciones y nombre de los tratamientos y fueron colocados
dentro de la cámara de germinación (TE-4020
Tecnal) para que vayan teniendo
una temperatura de trabajo de 15
°C.
En la cuarta
etapa
Se utilizó una cámara de germinación (TE-4020
Tecnal) para conchocelis que permitió estudiar los efectos
de los factores ambientales sobre estos procesos fisiológicos del cultivo Porphyra
(en su etapa conchocelis), la temperatura óptima
por cada proceso esporofita, intensidad de luz
(fotoperiodo, horas de luz). En este estudio,
debido a que la razón
principal para estos experimentos estaba relacio- nada con el cultivo artificial, también se exami-
naron parámetros como: Nitratos (NO3),
Fosfato (PO4) con el Standard Method2
4500-NO3-D- 2000y pH (USGS
Method I-1586-85).
Liberación de cigostopora
Lo primero que se hizo en esta etapa fue transferir los talos reproductivos, se cortaron y
se retiraron luego de ser sometidos a
estrés por una hora. Se usaron guantes
de nitrilo para la manipulación; cuidadosamente se retiró el papel aluminio y se cogieron las estructuras reproductivas con
pinza estéril para transferirlos dentro de matraces
estériles, todo esto fue realizado
dentro de una cámara de flujo laminar;
seguidamente, se llenaron
con agua de mar enriquecida con los fertilizantes comerciales y tapados con Parafilm.
De manera posterior
se diseñó un sistema de aireación
con tuberías de 0,5 cm de diámetros, con llave
de paso de aire, filtros de 0,22 micrómetros y
un flujo promedio
de 7,2 ± 0,8 L*s-1 para cada matraz (5 en total) más 1 g de peso Pyropia
sp. inmediatamente se cubrieron
con papel aluminio y se dejaron
airear por 24 horas para que pudieran liberar las cigotospora. Por último, en esta etapa,
se procedió al conteo de cigotospora, utilizando matraces de cultivo para determinar la densidad de esporas por cada matraz.
Inoculación de Cigotosporas y Asentamiento
Se utilizó el caldo de cigotosporas con el mayor número de células 1,25x108*L-1, se usó 40 ml de la
solución madre para cada unidad experimental, vertiendo con una pipeta esterilizada de 10 ml; además se agregó 2 ml de dióxido de germanio (GeO2) por litro, ya que el factor de contaminación es el desarrollo de
diatomeas, luego se selló el vaso de
precipitado con Parafilm para evitar cualquier
fuente de contaminación del medio externo. Las valvas que estaban ya con las cigotosporas
estaban en asentamiento y fueron
mantenidas sin aireación por dos semanas con un fotoperiodo neutro (12 horas luz y 12 horas oscuridad) a 15 °C.
Posterior- mente, se retiró la valva
para evaluar el número de cigotosporas
asentadas y luego se cambió el medio de cultivo
semanalmente para evaluar
los parámetros de nitrato,
fosfato y otros.
Se contó el número de esporas asentadas 72 horas después de la siembra en el estereoscopio (AS ONE, SZM-T-LED). De esta manera,
se determinó el porcentaje de asentamiento (# de esporas
asentadas / # de esporas
sembradas) y se determinó la densidad de asentamiento (# de esporas asentadas y germinadas/valva).
Después de 48 horas, después
de la siembra se contó el número
de esporas germinadas donde se determinó la densidad de germinación
(número de esporas germinadas/valva) y porcentaje de germinación (número
de esporas germinadas / número de esporas
asentadas).
Diseño experimental
En la etapa de asentamiento y crecimiento del conchocelis
se aplicó un diseño completo al azar (DCA) con tratamientos al 0, 25, 50 y 100 por ciento,
tres unidades experimentales de conchas de abanico y 3 repeticiones.
Se usó un α = 0,05 donde previamente se
examinaron las suposiciones de ANOVA (homogeneidad de varianzas y distribu-ción normal).
Para determinar el
crecimiento de conchocelis entre los tratamientos de nutrientes se realizó comparaciones donde se utilizó la prueba Tukey.
Áreas
superficiales de las conchas de abanico La concha del bivalvo presenta
manchas que evidencian el crecimiento de conchocelis; por ello, se hizo un monitoreo en paralelo del crecimiento de estas en portaobjetos (Ruangchuay & Notoya, 2003); debido a que no es posible observar el crecimiento de dentro del bivalvo.
Por otro lado, se tomó fotografías de la superficie convexa de todos los bivalvos para
determinar el área superficial mm2 de conchocelis como se visualiza en la Tabla 1; obteniéndose el
porcentaje de cobertura (Gonzalez, 2018). Los bivalvos
no presentaron la misma área
superficial (*) ya que varían de
4225,8 a 6694,3 mm2; estos presentan diferencias en la desviación estándar
no mayor del
5 por ciento, cuya razón es el tamaño de los bivalvos,
ancho, largo e inclusive alto, ya que
la altura le da una curvatura
inclinada, generando en ellas una mayor área superficial y también se obtuvo la cobertura (**) de conchocelis en la superficie convexa del bivalvo.
Determinación de la calidad de agua de mar
Se observó
en los ensayos que el agua de mar proveniente de Paracas-Pisco, presentaba alta carga de material particulado, dificultando el análisis de diferentes parámetros. Por tal
motivo, se diseñó un sistema RAS con
UV integrado para disminuir la carga
microbiana; además, se añadió cloro con una dosis
de 2 ml por litro de agua de mar y adicionalmente de esterilizó, utilizando una autoclave a 121 °C por 25 minutos (Hafting, 1998).
Parámetros físicos para el Crecimiento de conchocelis
Para lograr los parámetros físicos del desarrollo inicial de la fase conchocelis de P. columbina se incubó a 12 °C - 15 °C, 40 - 60 μmol m-2 s-1 con fotoperíodo 12:12 (horas
luz: oscuridad) (Romo, 1995). Con ello, se obtuvieron los siguientes resultados (Tabla 2) en condiciones controladas de laboratorio.
Tabla 1
Área superficial convexa
de las valvas con el software FIJI-ImageJ
|
Área mm2*
|
Mean (mm)
|
StdDev (%)
|
Min (mm)
|
Max (mm)
|
Perim (cm)
|
Cobertura
%**
|
|
|
4334,8
|
1924,13
|
3,718
|
1010
|
2320
|
24,903
|
15,71
|
|
|
3987,5
|
1855,63
|
4,242
|
1100
|
2300
|
24,002
|
16,25
|
25Bay
|
|
4688,8
|
1772,42
|
3,335
|
1180
|
2220
|
25,882
|
13,52
|
|
|
4225,8
|
1967,45
|
4,356
|
1200
|
2450
|
24,783
|
18,82
|
|
|
4278,6
|
1858,47
|
4,33
|
1200
|
2540
|
24,903
|
16,23
|
25AyB
|
|
4856,1
|
1800,88
|
4,248
|
1200
|
2540
|
26,298
|
17,71
|
|
|
6166,5
|
1816,61
|
4,42
|
1120
|
2210
|
29,653
|
43,95
|
|
|
5157,4
|
2027,53
|
4,565
|
1120
|
2500
|
27,32
|
52,85
|
50Bay
|
|
5133,6
|
2019,66
|
4,113
|
1120
|
2440
|
27,284
|
49,74
|
|
|
4776,2
|
2075,36
|
3,264
|
1140
|
2450
|
26,197
|
25,65
|
|
|
5513,4
|
1847,96
|
2,645
|
1140
|
2430
|
28,241
|
25,78
|
50AyB
|
|
4721,2
|
1826,28
|
3,146
|
1140
|
2440
|
26,386
|
32,48
|
|
|
4924,7
|
2053,7
|
4,378
|
1140
|
2360
|
26,661
|
48,84
|
|
|
4683,5
|
1959,59
|
4,629
|
1140
|
2370
|
25,863
|
45,48
|
100AyB
|
|
4920,3
|
1800,97
|
4,32
|
1140
|
2140
|
26,601
|
54,93
|
|
|
4352,8
|
1895,92
|
2,325
|
1150
|
2140
|
25,107
|
71,56
|
|
|
5040,9
|
2069,48
|
4,316
|
1150
|
2330
|
27,04
|
61,52
|
100Bay
|
|
5168
|
2038,55
|
3,142
|
1150
|
2280
|
27,636
|
56,19
|
|
|
6694,3
|
2124,95
|
3,146
|
1170
|
2480
|
31,068
|
1,9
|
|
|
5992,8
|
1875,12
|
3,453
|
1170
|
2360
|
29,307
|
1,72
|
Control
|
|
5219
|
1887,66
|
2,107
|
1170
|
2280
|
27,727
|
2,82
|
|
Tabla 2
Parámetro de crecimiento de la fase inicial de la conchocelis de P. columbina
|
Tratamientos
|
T° (°C)
|
µmol m-2 seg-1
|
Salinidad (PSU)
|
Conduc tividad (mS)
|
TDS
(ppt)
|
Soluciones
|
|
25% -
1
|
15,01
|
16,1
|
36
|
55,887
|
25,9
|
|
|
25% - 2
|
15,02
|
16,2
|
36,2
|
56,197
|
26,6
|
|
|
25% - 3
|
15,03
|
15,7
|
36,1
|
56,042
|
27,7
|
|
|
50% - 1
|
15,02
|
15,8
|
36,01
|
55,902
|
25,2
|
Solución Hidropónica AyB La Molina
|
|
50% - 2
|
15,02
|
16,4
|
36,05
|
55,965
|
25,2
|
|
50% - 3
|
15,03
|
15,7
|
36,04
|
55,949
|
25,1
|
|
100% -
1
|
15,02
|
15,8
|
36,08
|
56,011
|
26,5
|
|
|
100% -
2
|
15,04
|
15,8
|
36,03
|
55,934
|
26,6
|
|
|
100% -
3
|
15,03
|
15,9
|
36,02
|
55,918
|
25,6
|
|
|
25% -
1
|
15,02
|
15,7
|
36,01
|
55,874
|
27,1
|
|
|
25% - 2
|
15,03
|
15,8
|
36,04
|
55,921
|
27,8
|
|
|
25% -
3
|
15,02
|
16,1
|
36,05
|
55,936
|
27,2
|
|
|
50% -
1
|
15,03
|
16,2
|
36,05
|
55,936
|
26,8
|
|
|
50% - 2
|
15,02
|
15,7
|
36,06
|
55,952
|
26,7
|
Bayfolan®
|
|
50% - 3
|
15,03
|
15,8
|
36,05
|
55,936
|
24,9
|
|
|
100% - 1
|
15,04
|
15,9
|
36,04
|
55,921
|
25,3
|
|
|
100% - 2
|
15,03
|
15,8
|
36,01
|
55,874
|
26,1
|
|
|
100% -
3
|
15,03
|
16,2
|
36,03
|
55,905
|
24,8
|
|
|
blanco - 1
|
15,01
|
16,1
|
36,04
|
55,908
|
25,1
|
|
|
blanco - 2
|
15,02
|
15,9
|
36,06
|
55,939
|
26
|
Control
|
|
blanco - 3
|
15,04
|
16,0
|
36,07
|
55,954
|
26,1
|
|
DesviaStand
|
0,009
|
0,21
|
0,042
|
0,070
|
0,920
|
|
|
Promedio
|
15,03
|
15,93
|
36,05
|
55,95
|
26,11
|
|
Tomando
en cuenta los principales problemas del cultivo
intensivo en tanques al aire libre o cerrado,
como la estructura del sistema
de cultivo, las características
de agua de mar, la estructura del sistema;
se destacó, la salinidad, características de
la luz y la temperatura de aclimatación de 15 °C durante todos días de experimentación (Carmona et al., 2006),
lo cuales influyeron en la composición bioquímica, el estado fisiológico y estructura. Por otro lado, con igual relevancia estuvieron presentes las
variables biológicas como la densidad de algas, la competencia de epífitas, pastaje
por herbívoros o la
contaminación bacteriana (Freidlander & Levy, 1995).
Absorción de Nitrato
Se analizó
la tasa de absorción de nitrato (𝑁𝑂−) con tratamientos
de diferentes porcentajes: 0 (control),
25, 50 y 100 por ciento. Los resultados de absorción de Nitrato en 𝑚𝑀 tuvieron
un comportamiento de crecimiento exponencial. De aquí en adelante
el fertilizante Bayfolan® tendrá la abreviatura “Bay” y la solución hidropónica A y B La Molina, será “AyB”. Las macroalgas tienen la capacidad de utilizar, absorber
y metabolizar rápidamente diferentes formas de nitrógeno inorgánico, principalmente nitrato y amonio, dependiendo de su disponibilidad. Sin
embargo, la presencia de estos compuestos nitrogenados
pueden ser tóxicos o inhibidores para algunas algas
marinas en altas concentraciones (Lobban
& Harrisson, 1994).
Las absorciones de nutrientes varían con factores físicos,
químicos y biológicos. En particular, la luz y la temperatura que influyen en las tasas de absorción de nutrientes (Harrison &
Hurd, 2001). Se trabajó
con una temperatura promedio de 15,03
 °C y fotones
μmol m-2 s-1 de 15,93. Estas dos variables influyen
en las tasas de absorción
de nutrientes. La absorción de nitrato (𝑁𝑂−) por parte
de las algas, depende de la luz (periodos), mientras
que el amonio (𝑁𝐻+) puede ser menos depen- diente
de la luz (Lobban & Harrison, 2004). En la
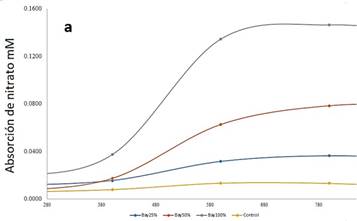
Figura 1-a se observa la absorción del nitrato 𝑚𝑀 por conchocelis en un periodo de 400 h a
800 h, luego comienza la meseta decreciente. Las diferentes
concentraciones de Bay al 100%, 50% y 25%
fueron 0,165; 0,083 y 0,041 de nitrato en 𝑚𝑀 respectivamente.
°C y fotones
μmol m-2 s-1 de 15,93. Estas dos variables influyen
en las tasas de absorción
de nutrientes. La absorción de nitrato (𝑁𝑂−) por parte
de las algas, depende de la luz (periodos), mientras
que el amonio (𝑁𝐻+) puede ser menos depen- diente
de la luz (Lobban & Harrison, 2004). En la
Figura 1-a se observa la absorción del nitrato 𝑚𝑀 por conchocelis en un periodo de 400 h a
800 h, luego comienza la meseta decreciente. Las diferentes
concentraciones de Bay al 100%, 50% y 25%
fueron 0,165; 0,083 y 0,041 de nitrato en 𝑚𝑀 respectivamente.
Según Romo et al. (2005),
para el cultivo en invernadero de conchocelis se adiciona el nutriente el abono agrícola Bayfolan® (0,1 ml por litro de agua de mar). El presente estudio se
centró en el seguimiento del nitrato en un tiempo de 1600 horas
con la concentración de stock de 41 g/L de nitrato (𝑁𝑂− − 𝑁) (NO3--N), 47 g/L de Nitrógeno Amoniacal (𝑁𝐻+ − 𝑁) en Bayfolan®.
Adicionalmente, se cultivó
in vitro, en frascos de
500 ml, concentración inicial de 0,165 𝑚𝑀 del volumen recomendado por Romo et al. (2005).
Tomando en consideración que la concentración de nutrientes en el
agua de mar fue determinada por el equilibrio entre la tasa de suministro de nutrientes y la demanda de esta; si la concentración de nutrientes es muy baja para el agua de mar, esta no indica que las algas mantienen
una concen- tración de nutrientes limitada, moderada o
severa (Harrison & Hurd, 2001).

Figura 1. Absorción de nutrientes y crecimiento. a) comportamiento de la absorción de
Nitrato con el fertilizante Bay. b) comportamiento de la absorción de Nitrato con el
fertilizante AyB. c) niveles de absorción
de fósforo para el fertilizante Bay.
c) niveles de absorción de fósforo para el fertilizante. e) crecimientos con el fertilizante Bay. e) crecimientos con el fertilizante AyB. Crecimiento mm2.
Se
realizó el análisis de nitrato en el agua de mar teniendo como resultado
0 mg/L, el dato inicial sirvió como referencia para la concentración inicial y así evitar la sobre saturación en el diseño experimental
que pudo generar de ecotoxicidad en conchocelis.
También
se puede observar que los tratamientos de 25% (0,04 𝑚𝑀), 50% (0,08 𝑚𝑀), 100% (0,15
𝑚𝑀) y el control
0% (0,01 𝑚𝑀) presentan una hipérbola
rectangular. La ecuación
que describe esta curva se conoce como la ecuación
de Michaelis Menten,
V= Vmáx (S/Ks + S); donde, “S” es la concentración
del nutriente, “Vmáx” es la tasa de absorción máxima,
“Ks” es el valor de media saturación y "𝛼" que significa la pendiente inicial
de la hipérbola rectangular V vs S.
Según Harrison & Hurd (2001),
la absorción controlada internamente del nutriente
está regulada por la
asimilación de nitrato a amonio donde
el paso de limitación de la velocidad es la conversión de nitrato a nitrito por la enzima
nitrato reductasa o, en el caso del amonio, la conversión de (𝑁𝐻+) a aminoácidos. Esto ocurre dentro de conchocelis por la cantidad de nitrógeno
limitado en el experimento; sin
embargo, se dio una mayor cantidad de ramilletes (Romo et al., 2005) por mm2 del bivalvo debido a
que la fórmula de Bayfolan® presenta la hormona de crecimiento ácido 3-indol acético al 0,00024
%w/v, donde se evidenció mayor cobertura de 63,09% de conchocelis
en el bivalvo a pesar de que el
nitrato es limitado, mas no, diámetro
de crecimiento, este crecimiento es común
cuando se agregar está hormona ácido 3- indol acético
en microalgas (Portero, 2020).
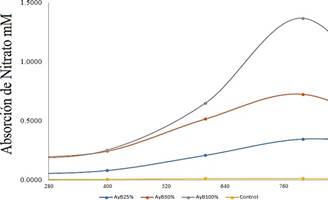
Por
otro lado, la solución AyB al 100, 50 y 25 por
ciento como vemos en la Figura 1-b; tuvo una absorción de nitrato de 1,37; 0,73 y 0,35 𝑚𝑀 respectivamente, siendo estos los
resultados con promedios más altos a
diferencia del control que tiene 0,01
𝑚𝑀 de nitrato. Las concentraciones de absorción de AyB es mayor que en Bay de 100% y 50% en 8.1 veces más altas en las 200
horas de absorción; sin embargo, el
de 25% fue 7,7 veces mayor. Estos
resultados son mayores que los que reporta (Pedersen
et al., 2004) donde reportan
que HMC con 30 𝜇𝑀 de nitrato fue 7 veces mayor a 15
°C que LMC con 3 𝜇𝑀 de nitrato en Porphyra s.
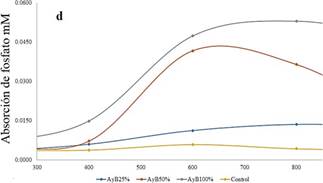
Absorción de Fosfato
Los resultados de los tratamientos de Bay al 100,
50 y 25 por ciento;
presentaron como máxima absorción promedio
de 0,0312; 0,0149
y 0,0073
𝑚𝑀 respectivamente, pero en diferentes tiempos. Según la concentración usada por Romo et al. (2005)
con el fertilizante líquido Bayfolan®, que tiene una concentración inicial de 0,03 𝑚𝑀 de Fosfato,
la cual fue añadida en 16 recambios de medio
enriquecido en toda la experimentación que
tuvo un total de 1600 h, a diferentes tiempos de absorción de Fosfato; se analizó en el intervalo de 400 a 1000 h. Comenzando por el control
que va desde un mínimo 400 hasta las 600 h, lo cual presenta una absorción máxima promedio de 0,0059 𝑚𝑀 de fosfato de manera natural,
en la Figura 1-c podemos
apreciar a los tratamientos con Bay de 100, 50, 25 y 0 por ciento, que tuvieron los
tiempos
de máxima absorción con 1000, 800 y 600 horas, respectivamente.
Usando un medio comercial
se presentó una máxima
absorción en los tratamientos de 100, 50, 25
y cero por ciento con 0,0530; 0,0417; 0,0136 y
0,0059 de fosfato
𝑚𝑀 respectivamente. Los tratamientos presentan
diferentes tiempos de absorción
como por ejemplo 100 y 25 por ciento,
ya que presentan su máxima
absorción en las 1000 horas, sin embargo, el tratamiento de 50 y cero por ciento están
en las 600 horas.
Estudios en diferentes especies
Porphyra purpurea,
P. rosengurtii, P. leucosticta halotipo y tipo
A, han utilizado diferentes rangos,
mínimo de 0,5 micro- mol y máximo 3,0 micromol
de fosfatos para el crecimiento de biomasa de Porphyra en
su estado Gametofítica (Pedersen
et al., 2004), a diferencia del experimento esporofítico. Por otro lado, la experimentación en la fase Gametofítica fue de 30 a 60 h (tiempo de absorción); sin embargo, en la etapa esporofítica se tuvo que esperar de 2 a
3 meses de crecimiento de conchocelis (Romo et al., 2005).
Área (en mm2) de crecimiento de Porphyra
sp. Se ha realizado un monitoreo del crecimiento del filamento de conchocelis con el microscopio Trinocular iScope EuroMex
más la cámara digital calibrada para tomar las fotos de crecimiento de los filamentos desde las 10 h luego del asentamiento hasta las 900 h, ya que la cámara no pudo evidenciar más filamentos como también se reporta en el método de Romo & Paula (1995) donde el crecimiento de conchocelis se registró semanalmente, como la frecuencia relativa de filamentos que atraviesan el diámetro
ocular del microscopio.
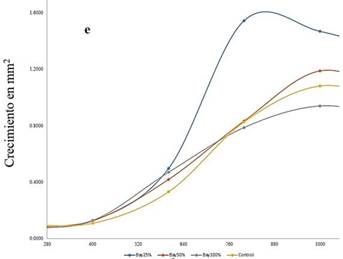
La cantidad inicial
de cigotospora fue de 125 millones
por mililitro en la cual se puede evidenciar un porcentaje de germinación hasta las 1350 horas con un mínimo de 0,00003 en el control y
con un máximo promedio de 0,0027 en
el tratamiento de Bayfolan® como se observa en la figura 1-E, trayendo consigo la cobertura de
conchocelis en 0,75±0,2248 y 7156±7,804, respectivamente, como se puede apreciar en la Figura 2.
Con un p-value < 0,05 el análisis de varianza determinó si existe diferencias
significativas entre los diferentes tratamientos con el producto de Bayer
Bayfolan®. Los valores obtenidos oscilan de 0,1081 a 1,5442
mm2.
Se podría evidenciar que los resultados de Bay 25% presenta
mayor crecimiento de conchocelis con un 1,5442 mm2 a un tiempo 800 h presentando diferencia significativa de los demás tratamientos a pesar de tener bajo el porcentaje (25%) de la concentración que se añadió para el cultivo conchocelis trabajado por (Romo et al.,
2005), así mismo tuvo una menor cobertura promedio
de 15,16. Sin embargo, los
tratamientos de Bay de 50, 100 por
ciento y control, que tuvieron su máximo crecimiento a las 1000 h, tuvieron
el área de crecimiento en 1,187; 0,939 y 1,0798 mm2 y también
reportaron una cobertura
promedio de 48,84;
63,09 y 0,943; respectivamente, el comportamiento de las variables
se puede observar
en la Figura 1-F.
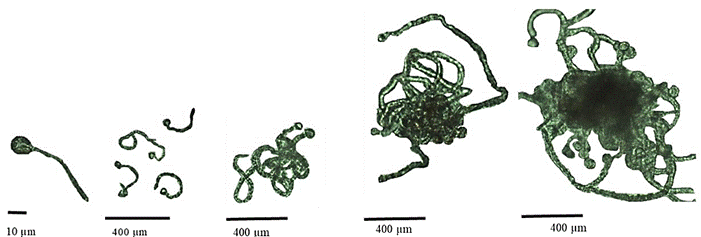
Figura 2. Crecimiento y desarrollo de la Cigotospora a Conchocelis, Pyropia sp. desde las 0 h hasta las 800 h.
Por
otro lado, los valores señalados anteriormente
no necesariamente indica que su tasa de crecimiento
sea lo idóneo, ya que los valores en el experimento
con Bayfolan difiere con el trabajo de crecimiento en hojas de Porphyra a 15 °C y con el mismo Fotoperiodo 12:12 (Hafting, 1998).
Este
crecimiento de los filamentos de conchocelis
para generar mayor cobertura posiblemente se deba a la hormona
Ácido Indol Acético (AIA) que desató
cierto “crecimiento acelerado” como se da en
las algas para obtener biomasa (Portero, 2020); sin embargo, también
se pudo observar
el diámetro de los filamentos y son de menor radio que la solución que no tuvo hormona, solución
hidro- pónica A y B La Molina.
Ambos tratamientos con 25% han desarrollado mayor tasa de crecimiento por hora; sin
embargo, tienen menor cobertura de crecimiento de los filamentos sobre la valva. Así mismo, la tasa de crecimiento al 50% de Bay es aproximadamente
diez veces menos que la solución
hidropónica. Sin embargo, en el tratamiento de los 100% la tasa de crecimiento de Bay ha presentado decrecimiento, siendo este el de menor diámetro a diferencia de los demás tratamientos. Esta medida también
es reportada en la reducción
de tasa de crecimiento llamado
desintegración (Hafting, 1998).
Por otro lado, AyB tuvo una tasa más lenta que la
de 25%. Con un p-value < 0,05 el análisis de varianza determina que si existe
diferencias significativas entre los diferentes tratamientos con la
fertilizante solución hidropónica AyB La Molina®. Donde la solución del 25 por ciento tuvo un mayor
crecimiento de 4,1536
mm2 y un mínimo de 0,1404 mm2; por otro lado, se puede apreciar que las demás
gráficas de 50, 100 y cero por ciento, no presenta la curva exponencial, pero se asume que si para poder reemplazar a la fórmula, siendo sus valores 1,886; 1,957 y 1,0798 mm2 y sus mínimos
0,1130; 0,1180
y 0,1081 mm2, respectivamente.
Se
determinó que el crecimiento de Conchocelis,
Pyropia sp presenta
correlación media alta con nitrato asimilado y presenta una baja
correlación con el fosfato asimilado. Además, en ambas soluciones Bayfolan
y Sol. A y B La Molina,
el tratamiento con 25% presentó
mayor promedio de crecimiento
(en mm) en el periodo de 800 horas, por
esa razón, la concentración óptima para hacer
cultivos en invernaderos será para crecimiento asentada de 25% de conchocelis por superficie de sustrato
calcáreo. Asimismo, se determinó los efectos de Pyropia sp.
en su fase conchocelis,
logrando obtener
un mayor diámetro
de crecimiento y área de
conchocelis con la solución hidropónica
La Molina A y B, con un máximo de 4,15
mm2 a diferencia del fertilizante Bayfolan® que presentó menor diámetro y área a la vez de conchocelis por 1,54 mm2; sin embargo,
presentó mayor porcentaje de
cobertura 71,56% sobre el sustrato de Argopecten purpuratus. Cabe resaltar que, dichos resultados son base científica para futuras
investigaciones de cultivos de macroalgas (fase esporofitica) in vitro para
luego ser trasladadas al mar.
Al apoyo incondicional de mi familia,
mi eterna compañera L.M.V.M y mi maestro Dr.
Víctor Meza Contreras quien descansa en la gloria de Dios,
quien es testigo del enorme trabajo
sincero y honesto que se dio.
REFERENCIAS BIBLIOGRÁFICAS
Acleto, C., & Endo, J.
(1977). Las especies peruanas de Porphyra
(Rhodophyta, Bangiales), I. Taxonomía y distribución geográfica. Lima, Perú, Museo de Historia
Natural “Javier Prado”
UNMSM, 8 (Serie B Botánica
N° 29).
Aragón, B., Castillo, R.,
Zavala, J., Pastor, R., Castañeda, V., & Rujel,
J. (2012). Estudios sobre macroalgas pardas
en el sur del Perú.
2011-2015. Plan de capacitación. Informe IMARPE. Callao, Perú, 87.
Carmona, R., Kraemer, G. P., & Yarish, C. (2006). Exploring
Northeast American
and 50 Asian species of Porphyra for use in an integrated finfish-algal aquaculture system.
Aquaculture, 252(1),
54–65.
Food and Agriculture Organization. (2016).
The state of world fisheries and
aquaculture: contributing to food security and
nutrition for all. Roma, 200.
Friedlander, M., & Levy, I. (1995).
Cultivation of Gracilaria in outdoor tanks and
ponds. Journal of Applied
Phycology, 7, 315-324.
Gonzalez, A. (2018). Image J una herramienta indispensable para medir el mundo biológico. Recuperado de https://www.researchgate.net/publication/328253430_Im age_J_una_herramienta_indi spensable_para_medir_el_mundo_biologico.
Guiry, M.D., & Guiry, G. M. (2018). AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. http://www.algaebase.org; searched
on 10 August 2018.
Hafting, J. T. (1998).
Strategies for growth management of Porphyra
yezoensis (Ueda) blades in suspension cultures: a step towards land-based mariculture. In Statistics (Issue March).
Harrison,
P. J., & Hurd, C. L. (2001).
Nutrient physiology of seaweeds:
Application of concepts to aquaculture. Cahiers de Biologie Marine, 42(1–2), 71–82.
Kang, Y. H., Kim, S., Lee, J. B., Chung, I. K. y Park, S. R. (2014).
Nitrogen biofiltration capacities and
photosynthetic activity of Pyropia yezoensis Ueda (Bangiales, Rhodophyta): groundwork to validate its potential in integrated multi- trophic aquaculture (IMTA). Journal of Applied Phycology, 26(2), 947–955.
Lobban, C. S., & Harrison, P. J. (2004).
Seaweed Ecology and Physiology. In The
Physiological Ecology of Seaweed.
McHugh, D.J. (2002). Perspectivas para la
producción de algas marinas en los
países en desarrollo: la industria de algas marinas. FAO Circular de Pesca Nº 968.
Roma. 30.
Pedersen, A., Kraemer, G., & Yarish,
C. (2004). The effects of temperature and nutrient concentrations on nitrate and phosphate uptake
in different species
of Porphyra from Long Island Sound (USA). Journal of
Experimental Marine Biology and Ecology, 312(2), 235–252.
Portero, M. A. (2020).
Efecto del ácido indol 3-Acético (AIA) exógeno
en presencia de luz azul y blanca en la productividad de biomasa de tres biotipos de Chlorella
sp. en el alto andino ecuatoriano. In Malaysian Palm Oil Council
(MPOC), 21(1).
Ramírez, D. R. (1993).
Cultivo, adaptación morfológica y fisiopatología de macroalgas marinas
de interés industrial.
Romo, H., Ávila, M., Candía, A.,
Nuñez, M; Oyarzo, C., Galleguillos, F., & Cáceres, J. (2005). Manual
de técnicas de cultivo de “Luche” (Porphyra sp.). Proyecto FONDEF DO1 I 1148.
Chile.
Romo, H., & Paula, E. (1995).
Métodos experimentales para el cultivo de Porphyra. In Alveal, K; Ferrario, ME; Oliveira, EC; Sar, E. eds. Manual de métodos
ficológicos. Chile. Universidad de Concepción,
551-562.
Romo, Hector. (1995). Manual
de Metodos Ficologicos (K. A. M. F.
O. E. Sar (ed.); 1st ed.). Universidad
de Concepción de Chile. Ruangchuay,
R., & Notoya, M. (2003). Physiological Responses
of
Blade and Conchocelis of Porphyra
vietnamensis Tanaka et Pham-Hoang Ho
(Bangiales, Rhodophyta) from Thailand in Culture.
Algae, 18(1), 21–28.
Thomas, T. E., Harrison, P.,
& Taylor, E. (1985). Nitrogen uptake and growth of the germlings and mature thalli of Fucus
distiehus. Mar. Biol. 84, 267-274.
Vivanco, C., Álvarez, J. C., & Vodden, K. (2011). Extracción de algas en Pisco: Desafíos, oportunidades,
adaptación y perspectivas futuras. Industrial Data,
14(1),19-27.