Amblyomma
maculatum Koch (Figura 3 F y G)
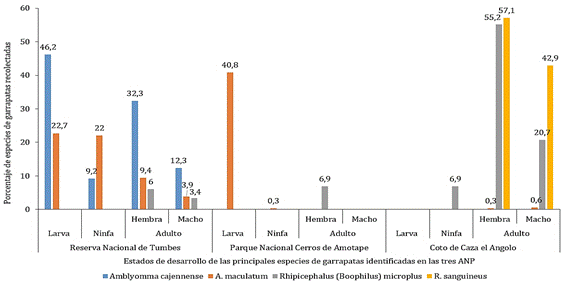
En la RNT se recolectaron larvas,
ninfas y adultos hembras y machos en P. maximun y larvas en una maleza no
identificada y conocida como frijolillo de campo. En la zona 1 se recolectaron
mayormente larvas y una ninfa en P. máximum, también fueron recolectadas
dos ninfas en asnos. En la zona 3 en ganado vacuno, se recolectaron una hembra
adulta y dos machos. Javier et al. (2011), reportan a esta especie para la
ciudad de Bogotá (Colombia) parasitando a caninos en infestaciones del orden
del 4,25% una alta tasa por tratarse de animales de compañía, domiciliados,
vinculados a planes de atención sanitaria, en una ciudad del trópico americano
con altura de 2 640 msnm, donde no se habían descrito antes. Crispell et al.
(2016) indican que esta especie cubre un rango geográfico que abarca áreas de
la costa del Atlántico este y el Golfo de México dentro de los Estados Unidos y
que es un vector del patógeno rickettsial del grupo de la fiebre maculosa, Rickettsia
parkeri, que causa la fiebre del boutonneuse americano, una forma similar
pero más leve que la fiebre manchada de las Montañas. También es vector de Hepatozoon
americanum. Esta especie de garrapata se ha convertido en un modelo para
estudiar las interacciones garrapata/Rickettsia (Ribeiro et al., 2023).
Amblyomma testudinis (Conil) (Figura 3 H e
I)
En la zona 2 se colectaron la cantidad de 13
adultos de I. iguana, de ellas, cinco fueron hembras y ocho machos. Con
relación a esta garrapata, Keirans citado por Guglielmone et al. (2001)
sinonimiza esta especie con A. argentinae. Lehman et al. (1971)
estudiaron la fototaxis, termotaxis, geotaxis y quimiotaxis de A. argentinae.
Posteriormente Guglielmone et al. (2009), consideran el nombre de esta especie
como invalido. Los mismos autores citados destacan haber encontrado esta especie
en áreas de las provincias del Chaco y del Monte en Argentina y como hospederos
a Chelonoides chilensis, B. constrictor occidentalis, Eunectes
notaus, Crotalus terrificus, especies de los géneros Bothrops
y Phrynops y también sobre especies de anfibios del género Bufo.
Haemaphysalis sp. (Figura 3 J y K)
De este género de especie aún no
identificada, se recolectaron de personas en la zona 1, una ninfa, un adulto
hembra y un macho. Al respecto, Bermúdez (2016) reporta para Panamá en tierras
bajas a Haemaphysalis juxtakocchi parasitando tapires, Jing-Jing et
al. (2016), en Malasia realizaron estudios de este género, de la comunidad
bacteriana de garrapatas en perros, gatos y pollos en dos aldeas locales
indígenas, habiéndoseles implicado como vectores potenciales de enfermedades
para los seres humanos y animales en todo el mundo. Según Kang et al., (2016) y
Khoo et al., (2016) varias bacterias patógenas han sido previamente
detectadas en garrapatas Haemaphysalis, incluidas los agentes de la
enfermedad para la fiebre moteada rickettsial, tifus de garrapatas,
anaplasmosis y ehrlichiosis. Ilia – Rochlin et al. (2023) reportan que, desde
su descubrimiento en los Estados Unidos en 2017, la garrapata Haemaphysalis
longicornis se ha detectado en la mayoría de los estados del este entre
Rhode Island y Georgia.
Rhipicephalus (Boophilus)
microplus (Canestri-ni) (Figura 3 L y M)
En la zona 3 se colectaron dos
ninfas y 11 adultos (ocho hembras y tres machos) en caballos, seis adultos en
vacunos (cuatro hembras y 2 machos), 3 adultos en caprinos (dos hembras y 1
macho) y dos hembras adultas en caninos. En la zona 1, en personas se
encontraron dos hembras. En la zona 2 en vacunos, se colectaron dos
hembras y un macho.
Navarrete et al. (2014) para El Salvador, la
han encontrado parasitando a bovinos (Bos taurus), canino (Canis familiaris),
equino (E. caballus), venado (Odocoileus virginianus), caprino (Capra
hircus) y humano. En Argentina, se indica que es una garrapata introducida
y específica de los bovinos, a los cuales infesta severamente y transmite
enfermedades como la babesiosis, causando importantes pérdidas a la producción
ganadera y daños indirectos ocasionados por la transmisión de tres agentes
etiológicos: B. bovis, B. bigemina y Anaplasma marginale
(Domínguez-García et al., 2010).
Para Panamá, Bermúdez (2016) manifiesta que
esta especie es investigada por provocar serios daños a la industria ganadera.
En Cuba, Rodríguez & Suarez (2013) destacan que el bovino es el hospedero
principal, y que es un parásito que ocasiona considerables pérdidas en la
explotación ganadera, de forma directa, por la succión de sangre, el deterioro
de los cueros, y de forma indirecta, como transmisor de agentes causantes de
hemoparásitosis (como babesisiosis, anaplas-mosis y theileriosis), que provocan
enfermedad e incluso pueden causar la muerte a los animales.
Guerrero et al. (2014) indican que es una
plaga parásita del ganado obligada que ha establecido poblaciones en todas las
regiones tropicales y subtropicales del mundo es responsable de importantes
pérdidas económicas para los productores de ganado. Valencia et al. (2017), en
estudios realizados en la meseta de Popayan en Colombia, destacan que la
prevalencia de garrapatas fue de 79,5%; de ellas, 99,6% eran R. microplus
y solamente el 0,4% correspondía a la especie Dermancentor nitens. Así
mismo, encontraron que la mayoría de los bovinos (58%) presentaron una
infestación media y alta.
Nava et al. (2022) hacen referencia que R.
microplus está restringido por las bajas temperaturas en otoño e invierno que
inhiben el desarrollo de sus huevos, pero la introducción de ganado infestado
con esta garrapata desde principios de primavera hasta finales de verano en
áreas de zonas templadas podría producir hembras grávidas que pondrían huevos y
que originarían larvas viables desde fines de la primavera hasta el invierno.
Rhipicephalus sanguineus (Latreille) (Figura 3 N y
Ñ).
Se recolectaron en la zona 3, la cantidad de 32
adultos (18 hembras y 14 machos) y se extrajeron de canes (ocho hembras y tres
machos), de vacunos (8 hembras y 11 machos) y de caprinos (dos hembras). Esta
especie, es conocida como garrapata marrón del perro, representa una amenaza
para la salud pública en todas las etapas de desarrollo como vector de Ehrlichia
canis (erliquiosis), Babesia canis (babesiosis) y Hapatozoon
canis (hepatozoonosis), que causan enfermedades que afectan a un gran
número de perros en todo el mundo (Dantas-Torres, 2010; Dantas-Torres &
Otranto, 2015).
Además, este parásito transmite varias bacterias,
como Rickettsia spp. (Ferreira-Borges et al., 2007). En Brasil, R.
sanguineus s.l. se informó que estaba infectado con R. parkeri, otro
agente etiológico de la fiebre maculosa brasileña (BSF), la enfermedad de la
fiebre manchada (Coutinho et al., 2005; Dantas-Torres et al., 2006; Cunha et
al., 2009; Abrego et al. 2010; Álvarez, 2012; Bermúdez, 2016; Moerbeck et al.,
2016; Barbosa-Silva et al., 2017).
Del mismo modo Bohrer et al. (2016) hacen notar que los adultos también pueden alimentarse de humanos y muchos otros mamíferos, como cabras, ovejas, ganado, caballos, carnívoros salvajes, gatos, liebres y erizos; garrapatas pre-adultas se han encontrado en musarañas y muchos roedores.
Abrego, L., Jiménez A., Romero, J., Montenegro,
V., Pereira, R., Salazar, L. & Dolz, G. (2010). Detección de Ehrlichia
spp., Anaplasma platys y Borrelia burgdorferi s.l. en garrapatas
recolectadas de perros en Costa Rica. Boletín de Parasitología, (4),
3-4.
Acevedo - Gutierrez, L. Y., Paternina, L. E.,
Labruna, M. B., Rodasa, J. D. (2021). Presence of two species of the Amblyomma
cajennense complex (Acari: Ixodidae) and probable zones of sympatry in
northwestern Colombia. Ticks and Tick- borne Diseases, 12, 6. doi.org/10.1016/j.ttbdis.2021.101815.
Alcalá - Canto, Y., Figueroa - Castillo, J. A.,
Ibarra - Velarde, F., Vera-Montenegro, Y., Cervantes - Valencia, M. E., Salem,
A. Z. M., & Cuéllar - Ordaz, J. A. (2018). Development of the first georeferenced map
of Rhipicephalus (Boophilus) spp. in México from 1970 to date and
prediction of its spatial distribution. Geospat Health, 7, 13(1),
624. doi: 10.4081/gh.2018.624.
Álvarez, V. (2003). Taxonomía de Garrapatas Duras
(Acari: Ixodidae) de importancia pecuaria en Costa Rica. Editorial Ministerio
de Agricultura y Ganadería, Dirección de Salud Animal. Programa de la Garrapata
San José, Costa Rica. 32 pp.
Álvarez, V. (2010). Control químico de las
garrapatas del bovino en Costa Rica. Boletín de Parasitología, 11
(4), 1.
Álvarez, V. (2012). Rhipicehalus sanguineus:
la garrapata café del perro, su control. Boletín de Parasitología, 13
(4), 3.
Álvarez, V. & Hernández, V. (2011). Hallazgos
de Amblyomma cajennense encontrados en Costa Rica (1937-2010), según
provincia y cantón. Boletín de Parasitología, 12 (1),
3-4.
Barbosa -Silva, A., Morato - Duarte, M., da Costa
-Cavalcante, R., Vilges de Oliveira, S., Figueiredo - Vizzoni, V., de Lima -
Duré, A. Í., Campos de Melo, F., Machado-Ferreira, E., Salles Gazêta, G.
(2017). Rickettsia
rickettsii
infecting Rhipicephalus sanguineus sensu lato (Latreille 1806), in high
altitude atlantic forest fragments, Ceara State, Brazil, Acta Tropica, 173,
30-33. doi.org/10.1016/j.actatropica.2017.05.018.
Beati, L., Nava, S., Burkman, E., Barros - Battesti,
D., Labrunas, M., Guglielmone, A., Cáceres, A., Guzmán-Cornejos, C., León, R.,
Durden, L. & Faccini, J. (2013). Amblyomma cajenense (Fabricius, 1787) (Acari: Ixodidae),
the Cayenne tick: phylogeography and evidence for allopatric speciation. BMC Evolutionary
Biology, 13, 267-287. Doi: 10.1186/147-2148-13-267
Bermúdez, S. (2016). Garrapatas de Panamá
distribución e importancia en ambientes naturales y antropogenizados. Boletín de
Parasitología, 17(4), 1.
Bohrer, M., Trombka, M., Liberato da Silva, G.
& Eugenio, C. (2016). Rhipicephalus sanguineus (Acari:
Ixodidae) Biting a Human Being in Porto Alegre City, Rio Grande Do Sul, Brasil.
Rev. Inst. Med. Trop. Sao Paulo, 58(1), 35. Doi:
10.1590/s1678-9946201658035.
Bona, M., Blaňárová, L., Stanko, M. et
al. (2022). Impact of climate factors on the seasonal activity of ticks
and temporal dynamics of tick-borne pathogens in an area with a large tick species
diversity in Slovakia, Central Europe. Biologia, 77,
1619–1631. https://doi.org/10.1007/s11756-021-00902-x
Ferreira – Borges, Lígia, M., Fernández – Soares,
Sara, Nogueira – Fonseca, Iracele., Vieira - Chaves, Vanessa & Braz- Louly
Carla Cristina. (2007). Resistência acaricida em larvas de Rhipicephalus
sanguineus (Acari: Ixodidae) de Goiânia-GO, Brasil. Revista de Patología
Tropical, 36(1), 87-95.
Carrascal, J., Oviedo, T., Monsalve, S. &
Torres, A. (2009). Amblyoma dissimile (Acari: Ixodidae) parásito de Boa
constrictor en Colombia. Rev. MVZ Córdoba, 14(2), 1745-1749.
Compaoré, S., Boungou, M., Biguezoton, A. S.,
Thiombiano, N. G., Zannou, O. M., Ouedraogo. A. S., & Kabré. G. B. (2022) Tick
species infesting cattle in the central region of Burkina Faso: Presence of Rhipicephalus
microplus less than ten years after its first identification in the
Southwest part of the country. Ticks Tick Borne Dis., 13(5), 101983.
doi: 10.1016/j.ttbdis.2022.101983.
Coutinho, M. T., Bueno, L. L., Sterzik, A.,
Fujiwara, R. T., Botelho, J. R., Maria, M., Genaro, O. & Linardi, P. M. (2005).
Participation
of Rhipicephalus sanguineus (Acari: Ixodidae) in the epidemiology of
canine visceral leishmaniasis. Veterinary Parasitology, 128, 149-155.
Doi: 10.1016/j.vetpar.2004.11.011.
Crispell, G., Budachetri, K. & Karim, S.
(2016). Rickettsia parkeri colonization in Amblyoma maculatum:
the role of superoxide dismutases. Parasites & Vectors, 9,
291-303.
Cumbie, A. N., Whitlow, A. M., Arneson, A., Du. Z,
& Eastwood, G. (2022) The Distribution, Seasonal Abundance, and
Environmental Factors Contributing to the Presence of the Asian Longhorned Tick
(Haemaphysalis longicornis, Acari: Ixodidae) in Central Appalachian
Virginia. Journal of Medical Entomology, 59, 1443–1450. https://doi.org/10.1093/jme/tjac067.
Cunha, E., Matos, R., Pereira, N. R. C, Oliveira,
P. R., Daemon, E. & Camargo-Mathias M. I. (2017) Histopathological
changes in the liver and thyroid of mice (Mus musculus) caused by the
acaricides: fipronil and thymol. J Histol Histopathol., 4, 9.
http://dx.doi.org/10.7243/2055-091X-4-9
Dale, W. (1981). Fundamentos sobre
Morfología, Biología y Clasificación de Arañas, Escorpiones, Ácaros e Insectos
con Importancia Sanitaria Para el Hombre y Animales Domésticos. Edit.
Universidad Nacional Agraria-La Molina. 40 pp.
Dantas-Torres, F., Otranto, D. (2015). Further thoughts on the
taxonomy and vector role of Rhipicephalus sanguineus group ticks, Veterinary
Parasitology, 208, 9-13.
Dantas - Torres, F. (2010) Biology and ecology of
the brown dog tick, Rhipicephalus sanguineus. Parasites
Vectors 3,
26. https://doi.org/10.1186/1756-3305-3-26.
Dantas - Torres, F., Aguiar, L. & Brandão - Filho,
S. (2006). Rhipicephalus
sanguineus
(Acari: Ixodidae), the brown dog tick, parasitizing humans in Brazil. Revista
da Sociedade Brasileira de Medicina Tropical, 39(1), 64-67. Doi:
10.1590/S0037-86822006000100012.
Defaye, B., Moutailler, S., Pasqualini, V., &
Quilichini, Y. (2022) Distribution of Tick-Borne Pathogens in Domestic Animals
and Their Ticks in the Countries of the Mediterranean Basin between 2000 and
2021: A Systematic Review. Microorganisms,16, 10(6), 1236.
doi: 10.3390/microorganisms10061236.
Domínguez - García, D., Rosario - Cruz, R.,
Almazán - García, C., Saltijeral- Oaxaca, J. & De la Fuente, J. (2010). Boophilus
microplus: Aspectos biológicos y moleculares de la resistencia a los
acaricidas y su impacto en la salud animal. Tropical and Subtropical Agroecosystems, 12(2), 181-192
Ernieenor, F. C., Ernna, G. & Mariana, A.
(2017). Phenotypic
and genotypic identification of hard ticks of genus Haemaphysalis
(Acari:Ixodidae) in Peninsular Malaysia. Exp. Appl. Acarol, 71, 387. Doi:
10.1007/s10493-017-0120-3
Estrada - Peña, A. (2015). Clase Arachnida, Orden
Ixodida: Las garrapatas. Revista IDE@-SEA, 13, 1–15.
Gregory N, Fernandez MP, Diuk-Wasser M. (2022)
Risk of tick-borne pathogen spillover into urban yards in New York City. Parasit Vectors, 15(1), 288.
doi: 10.1186/s13071-022-05416-2.
Guerrero, F., Andreotti, R., Bendele, K., Cunha,
R., Miller, R., Yeater, K. & Pérez de León, A. (2014). Rhipicephalus (Boophilus)
microplus
aquaporin as an effective vaccine antigen to protect against cattle tick
infestations. Parasit. Vectors, 7, 475-487. Doi:
10.1186/PREACCEPT-7072367031355619.
Guglielmone, A. A. & Nava, S. (2005). Las
garrapatas de la familia Argasidae y de los géneros Dermacentor, Haemaphysalis,
Ixodes y Rhipicephalus (Ixodidae) de la Argentina: distribución y hospedadores.
Rev. Inv.
Agropec., 34,
123-141.
Guglielmone, A. A., Robbins, R. G., Apanaskevich,
D. A. et al. (2009) Comments on controversial tick (Acari: Ixodida)
species names and species described or resurrected from 2003 to 2008. Exp
Appl Acarol, 48, 311. https://doi.org/10.1007/s10493-009-9246-2
Guglielmone A. A., Robbins, R. G., Apanaskevich,
D. A., Petney, T. N., Estrada-Peña, A., Horak, I. G., Shao, R. & Barker, S.
C. (2010). The Argasidae, Ixodidae, and Nuttalliellidae (Acari: Ixodida) of the
world: A list of valid species names. Zootaxa, 25(28),
1-28. Doi:10.5281zenodo.196488
Guglielmone, A. A., Luciani, C. A. & Mangold,
A. J. (2001). Aspects
of the ecology of Amblyomma argentinae Neumann, 1904 [Amblyomma
testudinis (Conil, 1877)] (Acari: Ixodidae). Systematic & Applied
Acarology Special Publications, 8, 1-12. Doi: http://dx.doi.org/10.11158/saasp.8.1.1.
Ilia Rochlin, J. L., Benach, M. B., Furie, D. G.,
& Thanassi, H. K. K. (2023). Rapid invasion and expansion of the Asian
longhorned tick (Haemaphysalis longicornis) into a new area on Long
Island, New York, USA. Ticks and Tick-borne Diseases, 14(2), 102088.
Javier, E., Javier, C. & Prieto, C. (2011). Garrapatas
(Acari: Ixodidae) prevalentes en caninos no migrantes del noroccidente de
Bogotá, Colombia. NOVA,
9(15), 113–214.
Jing - Jing, K., Fezshin, C., Kai, K., Azzy, I.,
Fang - Shiang, L., Kim - Kee, T., Li - Yen; C. & Sazaly, A. (2016). Bacterial
community in Haemaphysalis ticks of domesticated animals from the Orange
Ali communities in Malaysia. Ticks and Tick-borne Diseases, 7(5), 929–937.
Doi: http://dx.doi.org/10.1016/j.ttbdis.2016.04.013
Kaba, T. (2022) Geographical distribution of
ixodid ticks and tick-borne pathogens of domestic animals in Ethiopia: a
systematic review. Parasit Vectors, 15(1), 108. doi:
10.1186/s13071-022-05221-x.
Kang, J. G., Ko. S., Smith, W. B., Kim, H. C.,
Lee, I. Y. & Chae, J. S. (2016). Prevalence of Anaplasma, Bartonella
and Borrelia species in Haemaphysalis longicornis collected from
goats in North Korea. J. Vet Sci, 17, 207–216. Doi:
10.4142/jvs.2016.17.2.207.
Kaur, D., Jaiswal, K., & Mishra, S. (2017)
Effect of tick infestation on haematological parameters of calves. J Entomol
Zool Stud., 5, 107–11.
Khoo, J. J., Fezshin, C., Kho, L., Ahmad –
Shanizza, A. I., Lim, F. S., Tan, K. K., Chang, L. Y. & AbuBakar, S. (2016).
Bacterial community in Haemaphysalis ticks of domesticated
animals from the Orang Asli communities in Malaysia. Ticks Tick Borne Dis,
7, 929–937. Doi: 10.1016/j.ttbdis.2016.04.013.
Krebber, H. R., Mestra, A., Herrera, Y. M. &
Causil, L. (2017). Amblyomma dissimile en Boa constrictor
en cautiverio del Centro de Atención y Valoración de Fauna Silvestre de
Montería (Córdoba, Colombia). Rev. Med. Vet. 35:29-34. Doi: http://dx.doi.org/10.19052/mv.4386.
Lehmann, H. D., Roth, B. & Schneider, C. C.
(1971) Einige Befunde zur Sinnesphysiologie der Kaltblüterzecke Amblyomma
testudines Z. F. Parasitenkunde, 36, 169–178.
https://doi.org/10.1007/BF00259587.
Lu, M., Meng, C., Gao, X., Sun, Y., Zhang, J.,
Tang, G., Li, Y., Li, M., Zhou, G., Wang, W., Li, K. (2022) Diversity of
Rickettsiales in Rhipicephalus microplus Ticks Collected in
Domestic Ruminants in Guizhou Province, China. Pathogens., 27, 11(10),
1108. doi: 10.3390/pathogens11101108.
Mittermeier, R. A., Robles - Gil, P., Hoffman, M.,
Pilgrim, J., Brooks, T., Goettsch - Mittermeier, C., Lamoreux, J., & Da
Fonseca, G. A. B. (2005). Hotspots revisited: Earths biologically richest and
most threatened terrestrial ecoregions. Conservation International.
Washington.
Moerbeck,
L., Vizzoni, V. F., Machado - Ferreira, E., Cavalcante, R. C., Oliveira, S. V.,
Soares, C. A., Amorim, M., & Gazêta, G. S. (2016). Rickettsia (Rickettsiales:
Rickettsiaceae) Vector Biodiversity in High
Altitude Atlantic Forest Fragments Within a Semiarid Climate: A New
Endemic Area of Spotted-Fever in Brazil. J Med Entomol, 53(6),
1458-1466. doi: 10.1093/jme/tjw121.
Nava, S. Gamietea, I. J., Morel, N., Guglielmone,
A. A. & Estrada-Peña, A. (2022). Assessment of habitat suitability
for the cattle tick Rhipicephalus (Boophilus) microplus in temperate areas. Research
in Veterinary Science, 150, 10-21.
Navarrete, L.R., Rodríguez, E. A, Valle, C. A.,
Vargas, M. J., Romero, L E. (2014). Identificación de especies de Rickettsia
asociadas a garrapatas de la familia Ixodidae, en colección del Ministerio de
Agricultura y Ganadería, El Salvador Licenciatura, San Salvador, El Salvador,
Universidad de El Salvador. 114 p.
Ogrzewalska, M. & Printér, A. (2016). Ticks (Acari:
Ixodidae) as ectoparasites of Brazilian wild birds and their association with
rickettasial diseases. Brazilian Journal of Veterinary Research and Animal
Science, 53, 1-31.
Ribeiro, J. M. C., Bayona-Vásquez, N. J.,
Budachetri, K., Kumar, D., Frederick, J. C., Tahir, F., Faircloth, B. C.,
Glenn, T. C., & Karim, S. (2023). A draft of the genome of the Gulf Coast
tick, Amblyomma maculatum, Ticks and Tick-borne Diseases, 14(2),
102090. doi.org/10.1016/j.ttbdis.2022.102090.
Rodríguez, R. & Suarez, M. (2013). Control
integrado, mejor opción para luchar contra la garrapata del bovino Rhipicephalus
microplus. Boletín
de Parasitología, 14(2), 1-2.
Santiago - Nava, G., Ignacio J., Morel, N.,
Guglielmone, A. A. & Estrada-Peña, A. (2022). Assessment of habitat
suitability for the cattle tick Rhipicephalus (Boophilus) microplus in
temperate areas, Research in Veterinary Science, 150, 10-21.
Scofield, A., Bahia, M., Martins, A.,L., Góes-Cavalcante, G., Martins T. F., & Labruna, M. B. (2011). Amblyomma
dissimile Koch (Acari: Ixodidae) attacking Primolius maracana
Vieillot (Psittaciformes: Psittacidae) in the Amazon region, State of Pará,
Brazil. Neotrop
Entomol.,
40(4), 509-11.
Scott, J.D. & Durden, L.A. (2015). Amblyomma
dissimile Koch (Acari:Ixodidae) parasitizes bird captured in Canada. Systematic
& Applied Acaralogy, 20(8), 854-860.
Sertse, T., & Wossene. A. (2007). Effect of
ectoparasites on quality of pickled skins and their impact on the tanning
industries in Amhara regional state, Ethiopia. Small Rumin Res., 69, 55–61.
Sonenshine, D. E., Lane, R. S., & Nicholson,
W. L. (2002). Chapter 24: Ticks (Ixodida). Medical and veterinary entomology.
En:Mullen G, Durden L. Medical and Veterinary Entomology. Amsterdam:
Elsevier Science, 517-558.
Valencia, C. E., Appel, V. A., Ruíz, G. A. &
Salazar, H. (2017). Identification
and prevalence of ticks (Acari, Ixodidae) in bovines in five municipalities of
the Popayan Plateau (Colombia). Revista Colombiana de Ciencias Pecuarias, 30,
239-247.
![]() http://orcid.org/0000-0002-6170-9799 P.
S. Castillo-Carrillo:
http://orcid.org/0000-0002-6170-9799 P.
S. Castillo-Carrillo: ![]() http://orcid.org/0000-0002-0255-1047
http://orcid.org/0000-0002-0255-1047