Actividad de
recubrimientos de quitosano, nanopartículas de quitosano y ZnO contra hongos
aislados e identificados molecularmente de frutas con potencial de exportación
en la zona norte
del Perú
Activity of coatings
based on chitosan, chitosan and ZnO nanoparticles against fungi isolated and
molecularly identified from fruits with export potential in the northern area
of Peru
Gerardo Juan Francisco Cruz1,
*; Rosa Liliana Solís-Castro2; John Rimaycuna1;
José Luis Solís3;
Mónica Marcela Gómez3;
Rubén Alfaro1
1 Grupo de Investigación en
Aprovechamiento de Biomasa Agroindustrial para Diversas Aplicaciones, Facultad
de Ciencias Agrarias, Universidad Nacional de Tumbes, Ciudad Universitaria,
Barrio Pampa Grande s/n, Tumbes, Perú.
2 Departamento Académico de
Biología y Bioquímica, Facultad de la Salud, Universidad Nacional de Tumbes,
Ciudad Universitaria, Barrio Pampa Grande s/n, Tumbes, Perú.
3 Facultad de Ciencias,
Universidad Nacional de Ingeniería, Av. Tupac Amaru 210. Rimac,
Lima, Perú.
*
Autor corresponsal: gcruzc@untumbes.edu.pe (G. J. F. Cruz).
ID
ORCID de los autores
G.
J. F. Cruz:  https://orcid.org/0000-0001-6096-0183 R.
L. Solís-Castro:
https://orcid.org/0000-0001-6096-0183 R.
L. Solís-Castro:  https://orcid.org/0000-0002-1813-8644
https://orcid.org/0000-0002-1813-8644
J.
Rimaycuna:  https://orcid.org/0000-0002-2767-9733 J.
L. Solís:
https://orcid.org/0000-0002-2767-9733 J.
L. Solís:  https://orcid.org/0000-0001-5560-9241
https://orcid.org/0000-0001-5560-9241
M.
M. Gómez:  https://orcid.org/0000-0003-0990-0593 R.
Alfaro:
https://orcid.org/0000-0003-0990-0593 R.
Alfaro:  https://orcid.org/0000-0001-8749-1647
https://orcid.org/0000-0001-8749-1647
RESUMEN
Las pérdidas postcosecha de frutas de
exportación originan cuantiosas pérdidas económicas, siendo la acción de hongos
una de las principales causas. Para el control de estos se utilizan fungicidas,
muchos de los cuales tienen alta toxicidad y poder residual. La búsqueda de
alternativas al uso de estos se convierte en un tópico importante de
investigación. La presente investigación tuvo como objetivo evaluar
recubrimientos basados en quitosano, nanopartículas (NPs) de quitosano y ZnO
para inhibir hongos aislados de frutas con potencial de exportación en el norte
del Perú. En primer lugar, los hongos se aislaron e identificaron,
molecularmente en base al gen internal transcribed spacer (ITS), de arándano,
limón, uva y aguaymanto. Se prepararon recubrimientos líquidos de quitosano, con
diferentes concentraciones de nanopartículas de quitosano y ZnO. Estos
recubrimientos fueron evaluados in vitro sobre parte de los hongos
aislados utilizando la técnica de halos de inhibición. Los recubrimientos preparados
presentaron efecto antifúngico contra Alternaria Alternata (arándano), Aspergillus
tubingensis (limón), Aspergillus niger (limón), Thielaviopsis
ethacetica (limón) y Aspergillus niger (aguaymanto). Se determinó que la
concentración de NPs de quitosano no tuvo ningún efecto sobre la capacidad
antifúngica de los recubrimientos, mientras que las NPs de ZnO si tuvieron un
efecto directamente proporcional. Los recubrimientos en base a quitosano y NPs
de quitosano y ZnO tienen un potencial de uso como agente antifúngico en frutas
de exportación.
Palabras
clave: recubrimientos
biodegradables; nanopartículas de quitosano; ZnO; hongos; frutas.
ABSTRACT
Post-harvest losses of
export fruits cause considerable economic reductions, being fungal action one
of the main causes. To control these, fungicides are used, many of which have
high toxicity and residual power. The search for alternatives to their use
becomes an important research topic. The objective of this research was to
evaluate coatings based on chitosan, chitosan and ZnO nanoparticles (NPs) to
inhibit fungi isolated from fruits with export potential in northern Peru.
Firstly, fungi were isolated and identified, molecularly based on the internal
transcribed spacer (ITS) gene. From blueberry, lemon, grape and golden berry. Chitosan
coatings were prepared, with different concentrations of chitosan and ZnO
nanoparticles. These coatings were evaluated in vitro on some of the
isolated fungi using the inhibition zone technique. The prepared coatings
showed antifungal effect against Alternaria Alternata (blueberry), Aspergillus
tubingensis (lemon), Aspergillus niger (lemon), Thielaviopsis
ethacetica (lemon) and Aspergillus niger (golden berry). It was
determined that the concentration of chitosan NPs had no effect on the
antifungal capacity of the coatings, while the ZnO NPs did have a directly
proportional effect. Coatings based on chitosan and chitosan and ZnO NPs have
potential for use as antifungal agents in fruits for exportation.
Keywords: biodegradable
coverages; chitosan nanoparticles; ZnO; fungus; fruits.
Recibido: 17-10-2023.
Aceptado: 11-12-2023.
Una de las principales actividades económicas en Perú
es la actividad agrícola, la cual en los últimos años ha tomado gran
importancia debido a la exportación de frutas frescas. Las exportaciones
agrícolas en el 2022 ascendieron a US$ 9807 millones (ComexPeru, 2023), representando 1/6 de las exportaciones
totales peruanas. Sin embargo, las pérdidas durante la cosecha y postcosecha
pueden ser elevadas. Muchos de los factores que aumentan las pérdidas durante
la cosecha, postcosecha y transporte a mercado de destino son los daños
mecánicos por golpes, el ataque de plagas, fallos en la cadena de frío, fallos
en el envase y embalaje, entre otros.
Con el afán de combatir el ataque de plagas y el
deterioro de las frutas se utilizan una serie de pesticidas sintéticos que
tienen un alto poder residual. Por ejemplo, uno de los funguicidas post cosecha
de mayor utilización por su amplio espectro es el Tiabendazol, el cual está
calificado como Ligeramente Peligroso (Categoría III de la OMS). Sin embargo,
este tipo de productos enfren-tan cada vez con mayor frecuencia restricciones
de uso a nivel de mercados de alto poder adquisitivo, generando una necesidad
en la búsqueda de productos de bajo impacto ambiental y legalmente permitidos.
Producto de estas restricciones los pequeños productores por su vulnerabilidad
podrían verse afectados negativamente, derivando en pérdidas económicas significativas
y generando un importante problema social.
Por otro lado, otras de las actividades productivas importantes en Perú son la actividad
hidrobiológica y acuícola. Uno de los productos que ha tomado mucha
importancia debido a su abundancia es la Pota (Dosidicus gigas). En el
año 2022 se desem-barcó un total de 52619 t de este recurso (Produce, 2023), siendo el 10% un residuo denominado “pluma”. Este
residuo está constituido principal-mente por quitina, la cual tiene la ventaja
de ser convertida fácilmente en quitosano sin necesidad de pasar por el proceso
de blanqueo que utiliza gran cantidad de insumos químicos (Moreno et al., 2017).
El quitosano es un material derivado de la quitina
obtenida por deacetilación que exhibe una impor-tante actividad antibacteriana
sobre diferentes bacterias Gram positiva y negativa y hongos (Confederat et al., 2021; Ke et al., 2021), la mayoría de los cuales involucrados en
la descomposición de alimentos. Las materias primas para producir quitosano a
escala comercial incluyen desechos como exoesqueleto de langostino mediante una
serie de métodos de naturaleza química, enzimática y microbiológica (Kou et al., 2021).
Las aplicaciones del quitosano como antibacte-riano
incluyen recubrimientos o películas solo y combinado para combatir bacterias y
hongos durante la post cosecha de diversas frutas como manzanas (Camatari et al., 2017; Cosme Silva et al.,
2017; Khalifa, Barakat, El-Mansy, & Soliman, 2017; D. Kumar, Kumar, &
Pandey, 2018), fresas (Badawy et al., 2016), mango (Camatari et al., 2017; Cosme Silva et
al., 2017), banana et al., 2018), uva (Barka et al., 2018). El quitosano se ha impregnado o
funcionalizado con diversas nanopartículas con miras a no solo ampliar su
espectro antimicro-biano, sino también mejorar sus propiedades físicas,
mecánicas y térmicas. Algunas de estas nanopartículas utilizadas han sido ZnO,
Zn, Cu, Ag (Du et al., 2009; Gonzaga, 2016; Kumar et
al., 2018; Sámano-Valencia et al., 2013). También se ha estudiado el uso de quitosano en forma
de nano-partículas, dado que son mucho más efectivas contra bacterias y hongos
que atacan a las frutas y a los alimentos en general (Castelo et al., 2018; Kumar et al., 2018;
Llanos & Tadini, 2018; Lustriane et al., 2018).
Es evidente que existe aún mucho campo de estudio en la
temática, sobre todo relacionado con la combinación de dos o más agentes
antimicrobianos en forma de nanopartículas que permitan ampliar el espectro
antimicrobiano y antifúngico. Es así como en el presente trabajo de
investigación se evaluaron recubrimientos líquidos basados en quitosano de alto
peso molecular derivado de pluma de pota, nanopartículas de quitosano y ZnO
para inhibir los microorganismos que atacan a las frutas de exportación en el
norte del Perú.
Recolección
de Frutas
Las muestras de frutas fueron recolectadas de
diferentes áreas de producción y comercialización en la zona norte del Perú
(Tumbes, Piura). Estas frutas incluyeron arándanos, uvas, limón y aguaymanto.
Aislamiento
e identificación de hongos
Se utilizaron dos métodos, considerando si el
fruto presentó o no lesiones visibles. Para el primer caso, se utilizó 100 g de
cada fruta seleccionada y se diluyó 1:10 con agua peptonada estéril al 1%. Se
mezcló vigorosamente por 30 min en un agitador orbital para luego realizar
diluciones seriadas en agua peptonada al 1%. Luego se sembró por superficie en
agar patata dextrosa (PDA, Merck) suplementada con 100 mg/L de cloranfenicol.
Por otro lado, si las frutas presentaron lesiones se realizarán cortes de 0,5
cm de tejidos entre las zonas lesionadas y no lesionadas del fruto.
Posteriormente los cortes de tejidos se trataron en batería de desinfección que
comprendió lavados con hipoclorito de sodio al 1% por 1 min, etanol 70% por 1
min y tres lavados sucesivos con solución salina fisiológica estéril 0,85%
(SSFE). Los tejidos desinfectados se secaron en papel filtro estéril y se
sembraron por superficie en PDA suplementada con 100 mg/L de cloranfenicol.
Para el aislamiento de hongos, las placas
inoculadas se incubaron a temperatura ambiente por 5 días. Transcurrido el
tiempo de incubación, se realiza-ron recuentos de unidades formadoras de
colonias (UFC) y se purificaron los hongos de interés en nuevos agares de
cultivo. Posteriormente, las cepas aisladas se conservaron en tubos con agar
PDA (hongos) inclinados.
La
extracción de ADN se realizó utilizando el método estándar CTAB-DTAB. Se
procedió a pesar entre 30 mg de micelio fúngico en microtubos de 1,5 mL. Se
agregaron 600 μL de la solución de extracción DTAB (dodeciltrimetilamonio
bromuro 8%, NaCl 1,5%, Tris HCl 100 mM a pH 8,8 y EDTA 50 mM)), se agitaron en
el vortex por 20 s y se procedió a incubar a 75 °C por 10 min. Luego se agitó
en vortex por 20 s y se adicionaron 600 μL de cloroformo grado HPLC y se
agitó nuevamente en vortex por 20 s. A continuación, se centrifugó a 13000 g
durante 5 min. Se transfirió el sobrena-dante 250 μL a otro microtubo de
1,5 mL que contenía previamente 100 μL de solución CTAB (5%
cetiltrimetilamonio bromuro, 0,4 M NaCl) y 900 μL de agua destilada
estéril. Se agitó en vortex e incubó a 75 °C durante 5 min. Se enfrió a
temperatura ambiente y centrifugó a 13000 g por 10 min. Se eliminó el
sobrenadante, se re-suspendió el pellet (ADN) con 150 μL de solución
disolvente (NaCl 1,2 M), incubándose a 75 °C durante 5 min y se enfrió a
temperatura ambiente. A continuación, se centrifugó a 13000 g por 5 min y
después se transfirió el sobrenadante de 150 μL a un nuevo microtubo con
300 μL de etanol absoluto. Se agitó en vortex por 20 s y centrifuga a
13000 g por 5 min, luego se lavó el pellet con 500 μL de solución de
lavado (etanol al 75%), se volteó el tubo varias veces, se centrifugó a 7500 g
por 5 min y se procede a secar el pellet de ADN por 15 min, y se re-suspendió
con 200 μL de tampón TE (Tris 10 mM- EDTA 1 mM) y se conservó a -20 °C.
Los hongos se
identificaron utilizando los cebadores universales para hongos ITS1F e ITS4.
Las reacciones fueron realizadas con 2X Taq Mastermix GeneOn (0,1 U/µL Taq DNA
polimerasa, 0,4 mM dATP, 0,4 mM dGTP, 0,4 mM dCTP,
0,4 mM dTTP, 4 mM MgSO4, 20 mM KCl, 16 mM (NH4)2SO4,
20 mM tris-HCL, pH 8,8) De cada producto de amplificación de la reacción
en cadena polimerasa (PCR), 10 μL se migraron en gel de agarosa al 1 % con
tampón de migración TAE 1X. La migración se realizó a 120 V durante 20 min;
conjuntamente se migró un marcador de peso molecular de 50 pares de bases (pb).
Los geles se visualizaron utilizando un transiluminador UV.
Para la secuenciación bidireccional se utilizó 10 μL de los productos
obtenidos por amplificación de la PCR, y se colocaron en microtubos de 0,2 mL. La
secuenciación de las muestras fue realizada por la empresa Macrogen Inc de
Korea.
Preparación
y caracterización de los recubrimientos
Se prepararon por separado soluciones de quito-sano
derivado de pota (Dosidicus gigas) (Moreno et al.,
2017), alcohol
polivinílico (PVA), NPs de quitosano y NPs de ZnO. La solución de quitosano se
preparó disolviendo el quitosano con una solución de ácido acético al 1% (p/v)
en agitación constante. Una vez el quitosano estuvo totalmente disuelto se
filtró para eliminar algunas impurezas. La solución de PVA se preparó
disolviendo el PVA con agua ultrapura en agitación constante a 80 °C.
Para la preparación de nanopartículas de quito-sano,
se preparó una solución de quitosano 0,2% (p/v) en ácido acético al 1% (p/v).
Se disolvió tripolifosfato de sodio (TPP) en agua ultrapura a una concentración
de 0,3% (p/v). Luego, la solución de TPP se vertió gota a gota en la solución
de quitosano con agitación a 1000 rpm. La mezcla se agitó durante 20 min más y
luego se centrifugó a 10000 rpm por 15 min. Finalmente se recolectó la fase
liquida y se almacenó a 4 °C.
Las nanopartículas de ZnO se sintetizaron utili-zando
el método de precipitación y como agente precursor nitrato de zinc hexahidratado
(Cruz et al., 2020).
Una vez preparados los insumos se procedió a la
formulación de los recubrimientos líquidos. Para ello, la solución de quitosano
se mantuvo en agitación constante y se adicionó la solución de PVA y se mantuvo
agitación por 20 min. Luego se agregó las NPs de ZnO disueltas en agua
ultrapura, manteniéndose agitación por 20 min. Finalmente se agregó las NPs de
quitosano y el agua ultrapura y se homogenizó por 10 min. Se elaboraron
diferentes formulaciones, tal como se describe en la Tabla 1. El volumen total
de la solución del recubrimiento fue de 20 ml.
Se obtuvieron los espectros de espectroscopia
infrarroja con reflectancia atenuada (FTIR-ATR) (Shimadzu Tracer-100).
Tabla
1
Descripción
de los experimentos llevados a cabo en la presente investigación. Cada
componente en ml
|
Muestra
|
Quitosano (1%)
|
PVA (1%)
|
Sol,
ZnO
|
Sol.
NP-Q
|
Agua
|
|
NCh100-ZnO0
|
9
|
1
|
2(0g)
|
8
|
0
|
|
NCh50/50-ZnO0
|
9
|
1
|
2(0g)
|
4
|
4
|
|
NCh0-ZnO0
|
9
|
1
|
2(0g)
|
0
|
8
|
|
NCh100-ZnO0.02
|
9
|
1
|
2(0,02g)
|
8
|
0
|
|
NCh50/50-ZnO0.02
|
9
|
1
|
2(0,02g)
|
4
|
4
|
|
NCh0-ZnO0.02
|
9
|
1
|
2(0,02g)
|
0
|
8
|
|
NCh100-ZnO0.06
|
9
|
1
|
2(0,06g)
|
8
|
0
|
|
NCh50/50-ZnO0.06
|
9
|
1
|
2(0,06g)
|
4
|
4
|
|
NCh0-ZnO0.06
|
9
|
1
|
2(0,06g)
|
0
|
8
|
NP:
nanopartículas. Q: quitosano.
Pruebas
de inhibición antimicrobiana-selección de recubrimientos
Para el estudio de
inhibición de hongos por los diversos tratamientos se utilizó el ensayo de
halos de inhibición. De los hongos identificados se seleccionaron 5 en base a
la mayor incidencia en el deterioro de las frutas. Los hongos seleccionados fueron
inoculados en medio de cultivo PDA (patata dextrosa agar, Merck) por 5 a 7 días
para la obtención de esporas.
Para el ensayo se siguió la
metodología de Nehra et al. (2018), con algunas
modificaciones. Se utilizó PDA, y se sembró mediante placa vertida una
concentración de 1-3x106 esporas/mL de cada hongo. Una vez
solidificado el medio, se cortaron cuatro pocillos, y fueron llenados con 100 µL
de los recubrimientos líquidos formulados.
Las placas de agar se
incubaron a 28 °C. Para expresar los resultados se midió el diámetro de las
zonas de inhibición de los recubrimientos a los 5 d.
Identificación
molecular de hongos aislados de las frutas de exportación
En la Tabla 2 se muestra los resultados del
aislamiento e identificación de los hongos de las frutas analizadas. Aquí, se
muestra el tamaño de la secuencia nucleotídica en pares de bases (bp) y el % de
identidad comparada con las secuencias de la base de datos GenBank. En el caso
de arándano se han identificado especies de los géneros Alternaria, Fusarium
y Exserohilum. En el caso de limón las especies encontradas fueron
del género Aspergillus y Thielaviopsis, mientras que en el caso
de aguaymanto las especies encontradas están dentro de los géneros Alternaria,
Fusarium y Aspergillus.
En el caso de las uvas, tanto verdes como moradas,
las especies de hongos aisladas están dentro de los géneros Nigrospora, Cladosporium,
Botrytis y Alternaria.
Caracterización
de recubrimientos
En la Figura 1 se aprecian los resultados de
FTIR-ATR de los recubrimientos desarrollados. Estos son similares para todas
las muestras con un pico ancho entre 3000 – 3500 cm-1 que
correspondería al grupo funcional -OH o N-H. Se observa otro pico en 1640 cm-1,
el cual correspondería al estrecha-miento C=O (amida I) (Rahman et al., 2019) típico del quitosano.
Aparentemente las concentraciones de NPs de quitosano y ZnO en el recubrimiento
liquido es muy bajo para poder ser detectado por esta técnica de análisis.
Resultados
de las pruebas antimicrobianas contra hongos aislados de las frutas
En la Tabla 3 se muestran los resultados del
tamaño de halos de inhibición de los diferentes recubri-mientos aplicados sobre
los hongos aislados. Se aplicó un modelo bifactorial para evaluar la
concentración de NPs de quitosano y la de ZnO en el recubrimiento. En todos los
casos para un valor de α = 0,01 se observó que no existe diferencia
significativa en cuanto a la concentración de NPs de quitosano, sin embargo, si
se evidencia la diferencia significativa en función del factor concentración de
NPs de ZnO en el recubrimiento. Se puede apreciar que, en general, a mayor
concentración de NPs de ZnO en el recubrimiento mayor capacidad de inhibición
de los hongos evaluados.
Tabla
2
Especies
de hongos asiladas de las frutas con potencial de exportación
|
Fruta
|
Especie identificada
|
Tamaño de la
secuencia (bp)
|
% de
identidad
|
|
Arándano
|
Alternaria alternata
|
530
|
99,81
|
|
Arándano
|
Exserohilum rostratum
|
563
|
100,00
|
|
Arándano
|
Alternaria longipes
|
543
|
100,00
|
|
Limón
|
Aspergillus tubingensis
|
605
|
100,00
|
|
Limón
|
Aspergillus niger
|
568
|
99,83
|
|
Arándano
|
Fusarium solani
|
539
|
100,00
|
|
Aguaymanto
|
Alternaria alternata
|
538
|
100,00
|
|
Limón
|
Aspergillus niger
|
515
|
100,00
|
|
Limón
|
Thielaviopsis ethacetica
|
556
|
99,46
|
|
Limón
|
Thielaviopsis ethacetica
|
553
|
99,64
|
|
Aguaymanto
|
Fusarium oxysporum
|
557
|
100,00
|
|
Limón
|
Aspergillus niger
|
605
|
99,83
|
|
Aguaymanto
|
Alternaria alternata
|
539
|
100,00
|
|
Arándano
|
Alternaria alternata
|
528
|
100,00
|
|
Uva verde
|
Nigrospora sp,
|
514
|
99,81
|
|
Uva verde
|
Nigrospora sp,
|
528
|
99,81
|
|
Aguaymanto
|
Alternaria alternata
|
583
|
99,83
|
|
Aguaymanto
|
Aspergillus niger
|
566
|
100,00
|
|
Arándano
|
Alternaria alternata
|
539
|
100,00
|
|
Arándano
|
Alternaria alternata
|
506
|
100,00
|
|
Aguaymanto
|
Alternaria brassicicola
|
538
|
99,81
|
|
Uva morada
|
Cladosporium tenuissimum
|
555
|
100,00
|
|
Uva morada
|
Alternaria porri
|
525
|
100,00
|
|
Uva morada
|
Alternaria porri
|
525
|
100,00
|
|
Uva morada
|
Botrytis cinerea
|
546
|
100,00
|
|
Uva morada
|
Cladosporium colombiae
|
510
|
100,00
|
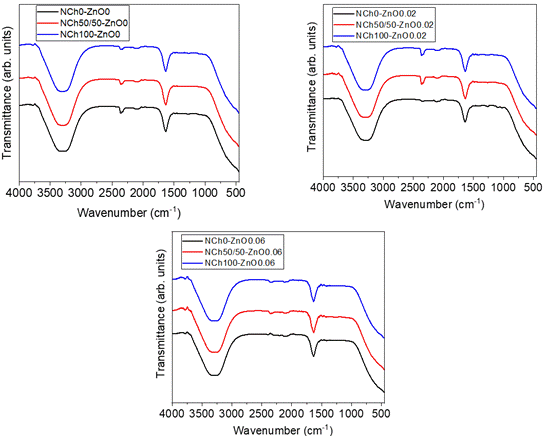
Figura 1. Espectros FTIR-ATR de los
recubrimientos obtenidos en la presente investigación.
Tabla
3
Resultados
de capacidad antifúngica (halos de inhibición en cm) de los recubrimientos
líquidos basados en NPs de ZnO y quitosano contra hongos aislados de frutas
|
Muestra
|
Alternaria
Alternata (Arándano)
|
Aspergillus
tubingensis (Limon)
|
Aspergillus
niger (limón)
|
Thielaviopsis
ethacetica (limón)
|
Aspergillus
niger (aguaymanto)
|
|
NCh100-ZnO0
|
0,9
|
0,9
|
0,95
|
1,1
|
0,95
|
|
NCh50/50-ZnO0
|
0,9
|
0,9
|
0,95
|
1,05
|
1
|
|
NCh0-ZnO0
|
0,9
|
0,9
|
1
|
1,25
|
1
|
|
NCh100-ZnO0.02
|
1
|
2
|
1,75
|
3,35
|
1,9
|
|
NCh50/50-ZnO0.02
|
1,1
|
1,2
|
1,25
|
1,05
|
1,15
|
|
NCh0-ZnO0.02
|
1,1
|
1,35
|
1,2
|
1
|
1,25
|
|
NCh100-ZnO0.06
|
2,45
|
2,5
|
2,25
|
3
|
2,5
|
|
NCh50/50-ZnO0.06
|
2,65
|
2,35
|
2,45
|
3,2
|
2,45
|
|
NCh0-ZnO0.06
|
2,3
|
2,05
|
2,1
|
2,4
|
2,4
|
En el caso de ZnO su capacidad antifúngica ha sido
corroborada en diversos trabajos donde incluso se ha logrado aumentar la vida
útil de productos frescos (Decelis et al., 2017;
Luksiene et al., 2020; Ruffo et al., 2019). El mecanismo antibacteriano de las NPs de ZnO es
consecuencia de su contacto directo de la pared celular o membrana de los
microrganismos resultando en la destrucción de la integridad de la misma. El ZnO
en medio acuoso libera iones Zn+2 y generan especies oxigeno
reactivas (Kim et al., 2022).
En otros estudios se ha demostrado la capacidad
antifúngica de NPs de quitosano (Abdel-Rahman et al., 2021;
Ruffo et al., 2019),
a diferencia del presente. Es posible que las concentraciones utilizadas en el
presente trabajo no hayan sido las suficientemente altas para provocar la
inhibición de los hongos evaluados.
Se prepararon diferentes formulaciones de recu-brimientos líquidos
de quitosano y nanopartículas de quitosano y ZnO, utilizando varias concentra-ciones
de cada componente utilizando dos técnicas de producción. Estos recubrimientos
fueron evaluados “in vitro” sobre hongos aislados e identificados
mediante halos de inhibición.
Los principales géneros de hongos aislados e identificados
molecularmente de las frutas incluyeron Alternaria, Exserohilum,
Aspergillus, Fusarium, Thielaviopsis, Nigrospora, Cladosporium y Botrytis.
Los recubrimientos presentaron efecto antifúngico contra Alternaria Alternata (arándano), Aspergillus
tubingensis (limón), Aspergillus niger (limón), Thielaviopsis
ethacetica (limón) y Aspergillus niger (aguaymanto). La concentración de NPs de
quito-sano no tuvo efecto sobre la capacidad antifúngica de los recubrimientos,
mientras que las NPs de ZnO si tuvieron un efecto directamente proporcional.
Los recubrimientos líquidos en base a quitosano y NPs de quitosano
y ZnO tienen un potencial de uso como agente antifúngico en frutas con
potencial de exportación.
A la Universidad Nacional de Tumbes por el
financiamiento del proyecto “Recubrimientos basadas en quitosano de alto peso
molecular derivado de pluma de pota (Dosidicus gigas), nanopartículas de
quitosano y ZnO para inhibir los microorganismos que atacan a las frutas de
exportación en el norte del Perú y su efecto sobre la vida útil”.
REFERENCIAS
BIBLIOGRÁFICAS
Abdel-Rahman, F.
A., Monir, G. A., Hassan, M. S., Ahmed, Y., Refaat, M. H., Ismail, I. A., &
El-Garhy, H. A. (2021). Exogenously Applied Chitosan and Chitosan
Nanoparticles Improved Apple Fruit Resistance to Blue Mold, Upregulated
Defense-Related Genes Expression, and Maintained Fruit Quality. Horticulturae,
7(8), 224.
Badawy, M. E.
I., Rabea, E. I., A. M. El-Nouby, M., Ismail, R. I. A., & Taktak, N. E. M.
(2016). Strawberry Shelf Life, Composition, and Enzymes Activity in Response to
Edible Chitosan Coatings. International Journal of Fruit Science, 17(2),
117-136. doi:10.1080/15538362.2016.1219290
Barka, E. A.,
Eullaffroy, P., Clément, C., & Vernet, G. (2004). Chitosan improves
development, and protects Vitis vinifera L. against Botrytis cinerea. Plant
Cell Reports, 22(8), 608-614.
Camatari, F. O.
d. S., Santana, L. C. L. d. A., Carnelossi, M. A. G., Alexandre, A. P. S.,
Nunes, M. L., Goulart, M. O. F., . . . Silva, M. A. A. P. d. (2017). Impact of
edible coatings based on cassava starch and chitosan on the post-harvest shelf
life of mango (Mangifera indica) ‘Tommy Atkins’ fruits. Food Science and
Technology.
doi:10.1590/1678-457x.16417
Castelo Branco
Melo, N. F., de MendonçaSoares, B. L., Marques Diniz, K., Ferreira Leal, C.,
Canto, D., Flores, M. A. P., . . . Montenegro Stamford, T. C. (2018). Effects
of fungal chitosan nanoparticles as eco-friendly edible coatings on the quality
of postharvest table grapes. Postharvest Biology and Technology, 139,
56-66. doi:10.1016/j.postharvbio.2018.01.014
ComexPeru.
(2023). Exportaciones Peruanas alcanzan record histórico. Retrieved from https://www.comexperu.org.pe/articulo/exportaciones-peruanas-alcanzan-record-historico-en-2022-con-envios-por-us-63193-millones
Confederat, L.
G., Tuchilus, C. G., Dragan, M., Sha'at, M., & Dragostin, O. M. (2021).
Preparation and Antimicrobial Activity of Chitosan and Its Derivatives: A
Concise Review. Molecules, 26(12). doi:10.3390/molecules26123694
Cosme Silva, G.
M., Silva, W. B., Medeiros, D. B., Salvador, A. R., Cordeiro, M. H. M., da
Silva, N. M., . . . Mizobutsi, G. P. (2017). The chitosan affects severely the
carbon metabolism in mango (Mangifera indica L. cv. Palmer) fruit during
storage. Food Chem, 237, 372-378. doi:10.1016/j.foodchem.2017.05.123
Cruz, G. J. F.,
Mondal, D., Rimaycuna, J., Soukup, K., Gómez, M. M., Solis, J. L., & Lang,
J. (2020). Agrowaste derived biochars impregnated with ZnO for removal of
arsenic and lead in water. Journal of Environmental Chemical Engineering, 8(3).
doi:10.1016/j.jece.2020.103800
Decelis, S.,
Sardella, D., Triganza, T., Brincat, J.-P., Gatt, R., & Valdramidis, V. P.
(2017). Assessing the anti-fungal efficiency of filters coated with zinc oxide
nanoparticles. Royal Society open science, 4(5), 161032.
Du, W.-L., Niu,
S.-S., Xu, Y.-L., Xu, Z.-R., & Fan, C.-L. (2009). Antibacterial activity of
chitosan tripolyphosphate nanoparticles loaded with various metal ions. Carbohydrate
Polymers, 75(3), 385-389.
Gonzaga A.
(2016). Effects of the plasticizers in the quality of flexible biodegradable
packages produced from chitosan based on shrimp (Penaeus vannamei) husk and ZnO
nanoparticles. (Forestry Engineering and Environment ), National uniersity
of tumbes, Tumbes.
Ke, C. L., Deng,
F. S., Chuang, C. Y., & Lin, C. H. (2021). Antimicrobial Actions and
Applications of Chitosan. Polymers (Basel), 13(6). doi:10.3390/polym13060904
Khalifa, I.,
Barakat, H., El-Mansy, H. A., & Soliman, S. A. (2017). Preserving apple (
Malus domestica var . Anna ) fruit bioactive substances using olive wastes
extract-chitosan film coating. Information Processing in Agriculture, 4(1),
90-99. doi:10.1016/j.inpa.2016.11.001
Kim, I.,
Viswanathan, K., Kasi, G., Thanakkasaranee, S., Sadeghi, K., & Seo, J.
(2022). ZnO nanostructures in active antibacterial food packaging: preparation
methods, antimicrobial mechanisms, safety issues, future prospects, and challenges.
Food Reviews International, 38(4), 537-565.
Kou, S. G.,
Peters, L. M., & Mucalo, M. R. (2021). Chitosan: A review of sources and
preparation methods. Int J Biol Macromol, 169, 85-94.
doi:10.1016/j.ijbiomac.2020.12.005
Kumar, D.,
Kumar, P., & Pandey, J. (2018). Binary grafted chitosan film: Synthesis,
characterization, antibacterial activity and prospects for food packaging. Int
J Biol Macromol, 115, 341-348. doi:10.1016/j.ijbiomac.2018.04.084
Kumar, S.,
Shukla, A., Baul, P. P., Mitra, A., & Halder, D. (2018). Biodegradable
hybrid nanocomposites of chitosan/gelatin and silver nanoparticles for active
food packaging applications. Food Packaging and Shelf Life, 16, 178-184.
doi:10.1016/j.fpsl.2018.03.008
Llanos, J. H.
R., & Tadini, C. C. (2018). Preparation and characterization of
bio-nanocomposite films based on cassava starch or chitosan, reinforced with
montmorillonite or bamboo nanofibers. Int J Biol Macromol, 107(Pt A),
371-382. doi:10.1016/j.ijbiomac.2017.09.001
Luksiene, Z.,
Rasiukeviciute, N., Zudyte, B., & Uselis, N. (2020). Innovative approach to
sunlight activated biofungicides for strawberry crop protection: ZnO
nanoparticles. Journal of Photochemistry and Photobiology B: Biology, 203,
111656.
Lustriane, C.,
Dwivany, F. M., Suendo, V., & Reza, M. (2018). Effect of chitosan and
chitosan-nanoparticles on post harvest quality of banana fruits. Journal of
Plant Biotechnology, 45(1), 36-44. doi:10.5010/jpb.2018.45.1.036
Moreno, E.,
Alfaro, R., Guzmán, V., S, Rimaycuna, J., & Cruz, G. (2017). Efecto de la
reducción del peso molecular de quitosano obtenido de plumas de pota (Dosidicus
gigas) utilizando dos métodos de despolimerización sobre su capacidad
antimicrobiana. Manglar, 13(1), 25-33.
Nehra, P.,
Chauhan, R., Garg, N., & Verma, K. (2018). Antibacterial and antifungal
activity of chitosan coated iron oxide nanoparticles. British journal of
biomedical science, 75(1), 13-18.
Produce. (2023).
Anuario Estadístico Pesquero y Acuícola 2022. Retrieved from https://ogeiee.produce.gob.pe/index.php/en/shortcode/oee-documentos-publicaciones/publicaciones-anuales/item/1116-anuario-estadistico-pesquero-y-acuicola-2022
Rahman, N. A.,
Abu Hanifah, S., Mobarak, N. N., Su'ait, M. S., Ahmad, A., Shyuan, L. K., &
Khoon, L. T. (2019). Synthesis and characterizations of o-nitrochitosan based
biopolymer electrolyte for electrochemical devices. PLoS One, 14(2),
e0212066. doi:10.1371/journal.pone.0212066
Ruffo, R. S., Youssef, K., Hashim, A. F., & Ippolito, A. (2019).
Nanomaterials as alternative control means against postharvest diseases in
fruit crops. Nanomater, 9, 1752.
Sámano-Valencia,
C., Martínez-Castañón, G., Martínez-Martínez, R., Loyola-Rodríguez, J.,
Reyes-Macías, J., Ortega-Zarzosa, G., & Niño-Martínez, N. (2013). Bactericide efficiency of a combination of chitosan gel with silver
nanoparticles. Materials Letters, 106,
413-416.
![]() https://orcid.org/0000-0001-6096-0183 R.
L. Solís-Castro:
https://orcid.org/0000-0001-6096-0183 R.
L. Solís-Castro: ![]() https://orcid.org/0000-0002-1813-8644
https://orcid.org/0000-0002-1813-8644 ![]() https://orcid.org/0000-0002-2767-9733 J.
L. Solís:
https://orcid.org/0000-0002-2767-9733 J.
L. Solís: ![]() https://orcid.org/0000-0001-5560-9241
https://orcid.org/0000-0001-5560-9241 ![]() https://orcid.org/0000-0003-0990-0593 R.
Alfaro:
https://orcid.org/0000-0003-0990-0593 R.
Alfaro: ![]() https://orcid.org/0000-0001-8749-1647
https://orcid.org/0000-0001-8749-1647