 |
INTRODUCCIÓN
¿Cuál es el rol de los fitobióticos en la producción animal?: Beneficios, biodisponibilidad, desafíos actuales y futuros
¿What is the role of phytobiotics in animal production?: Benefits, bioavailability, current and future challenges
Fredy Pajuelo Risco1; Daniel Castro Salinas2,*; Cesar Honorio Javes2; Juan Hernández Valdez2 ;
Ramiro Juan Vega-González2
1 Instituto de Educación Superior Tecnológico Público Daniel Villar, Jr. Sucre N° 124 Caraz, Huaylas, Perú.
2 Facultad de Ciencias Agropecuarias, Universidad Nacional de Trujillo. Av. Juan Pablo II s/n – Ciudad Universitaria, Trujillo, Perú.
* Autor corresponsal: dacastros@unitru.edu.pe (D. Castro-Salinas).
ID ORCID de los autores
F.M. Pajuelo- Risco: https://orcid.org/0000-0003-4135-6049 D. Castro-Salinas: https://orcid.org/0000-0002-5949-9104
C. E. Honorio-Javes: https://orcid.org/0000-0002-8917-7085 J. E. Hernández-Valdez: https://orcid.org/0009-0000-0885-5458
R. J. Vega-González: https://orcid.org/0000-0002-4261-2836
RESUMEN
Cada vez más países van incorporando nuevas normativas de inocuidad, seguridad sanitaria y alimentaria, respondiendo a la progresiva preocupación por el uso de antibióticos promotores de crecimiento (APC) en producción animal; la comunidad científica se ha visto obligado a buscar nuevas alternativas que reduzcan o sustituyan el uso de APC, con la capacidad de salvaguardar la salud pública. Dentro de esas alternativas, los fitobióticos son considerados una opción muy prometedora, ya que son sustancias naturales constituidas por complejos compuestos bioactivos. Este documento revisa las distintas aplicaciones y la funcionalidad de los fitobióticos en la producción animal. En primer lugar, se manifiesta los principales efectos y mecanismo de acción, destacando y explicando su funcionalidad como antioxidantes, antiinflamatorios, antimicrobianos, promotores de crecimiento, mejoradores de las características organolépticas de los alimentos y reductores de la generación de gases causantes del efecto invernadero, Segundo, se revisan aplicaciones destacadas de los fitobióticos a las distintas especies de interés zootécnico y su efecto que estos tienen. Finalmente, se indaga su biodisponibilidad y los desafíos actuales y futuros de los fitobióticos.
Palabras clave: Fitogénicos; fitobióticos; extractos de plantas; compuestos bioactivos; producción animal.
ABSTRACT
More and more countries are incorporating new safety, health and food safety regulations, responding to the growing concern about the use of antibiotic growth promoters (APC) in animal production, the scientific community has been forced to seek new alternatives that reduce or replace the use of (APC), with the ability to safeguard public health. Within these alternatives, phytobiotics are considered a very promising option, since they are natural substances made up of complex bioactive compounds. This document reviews the different applications and functionality of phytobiotics in animal production. Firstly, the main effects and mechanism of action are shown, highlighting and explaining their functionality as antioxidants, anti-inflammatory, antimicrobial, growth promoters, improvers of the organoleptic characteristics of foods and reduces the generation of gases that cause the greenhouse effect. Second, notable applications of phytobiotics to different species of zootechnical interest and their effect are reviewed. Finally, their bioavailability and the current and future challenges of phytobiotics are investigated.
Keywords: Phytogenics; phytobiotics; plant extracts; bioactive compounds; animal production.
Recibido: 16-12-2023.
Aceptado: 27-02-2024.
La producción animal cada vez se enfrenta a un sin número de problemáticas (Bastos et al., 2021), partiendo desde el cambio climático, el incalculable número de enfermedades, el uso excesivo de antibióticos como promotores de crecimientos (APC), la aparición de bacterias multirresistentes y la alta demanda de proteína de origen animal, etc. (Ayala et al., 2022).
Por las distintas limitaciones que presentan los APC en la producción de proteína animal (Sánchez-Torres et al., 2022) y para salvaguardando la salud pública en 2006 la Unión Europea y América del Norte prohibieron el uso de APC (Deminicis et al., 2021). La producción animal necesita nuevas estrategias sanitarias que acople eficacia y economía (Bastos et al., 2021), se ha impulsado investigación de sustancia no antibióticas como (probióticos, prebióticos, simbióticos, enzibióticos, ácidos orgánicos y fitobióticos) (Honorio-Javes et al., 2021; Leonor et al., 2017).
De las muchas alternativas que han surgido, los fitobióticos se muestran cómo una alternativa prometedora (Caicedo et al., 2022). Los fitobióticos o fitoquímicos son sustancias (polvo, extractos o aceites esenciales) extraídas de las plantas, ya sea de sus hojas, tallo, frutos, raíz o flores, que tienen una capacidad bactericida o bacteriostática, entre otros (Bastos et al., 2021) y que al ser añadidos a las dietas de los animales mejora significativamente los parámetros productivos (Buenaño & Sánchez, 2022).
Entre los compuestos bioactivos de los fitobióticos incluyen (carvacrol, flavonoides ,p-cimeno timol, linalool γ-terpineno, sabineno, saponinas, α-thujene, α-terpineno, n-alcanos, sesquiterpenos, eugenol, cumarinas, antocianidinas, eugenol, y otros) (Caicedo et al., 2022); sin embargo, debido a su diversidad de compuestos bioactivos, para poder ser incluidos en el agua o la dieta de los animales, es necesario de un procesamiento específico para mejorar la estabilidad, especificidad y calidad del producto, de esta manera aplicarlo a diferentes especies de una manera más eficaz y económica (Costa et al., 2011; Rosabal et al., 2017).
Un gran número de investigaciones reportan el uso de fitobióticos en distintos animales de interés zoo-técnico y concuerdan que los fitobióticos se caracte-rizan por su capacidad antiinflamatoria, antimicro-biana, promotor de crecimiento, antioxidantes, mayor digestibilidad de los nutrientes, entre otros (Gara et al., 2018; Kikusato, 2021); sin embargo, debido a que un fitobiótico está constituido por distintos com-puestos bioactivos, complejas estructuras químicas y moleculares, su biodisponibilidad puede ser afectados por una variedad de factores (Gessner et al., 2017; Manach et al., 2004) o también tener efecto negativo en los animales debido a su variabilidad fisiológica de estos. A esto hay que sumar el arduo esfuerzo de la comunidad científica que viene desarrollando importantes investigaciones sobre el uso de fitobióticos en la producción animal, lo cual se muestra en la Figura 2, se puede inferir que a partir del año 2011 hubo un incremento considerable de investigaciones sobre la aplicación de fitobióticos en la producción de diferentes especies de interés zootécnico, esto nos da entender que esta alternativa está teniendo una aceptación por parte de la industria pecuaria.
El objetivo de esta revisión es organización y selección los estudios más relevantes realizados sobre la aplicación de fitobióticos en la producción de las diferentes especies de interés zootécnico y el rol que desempeñan en la seguridad alimentaria, de esta manera proporcionar a la comunidad científica información actualizada.
¿Qué son los fitobióticos?
Conocidos también como fitoquímos o fitogénicos, son sustancias complejas de compuestos bioactivos (Bava et al., 2024; Miranda et al., 2021) que derivadas de cualquier parte de las plantas, estas pueden ser en polvo, aceite esencial o extractos (Caicedo et al., 2022), estos compuestos bioactivos son principalmente metabolitos secundarios o especializados (Gara et al., 2018), como muestra la Figura 1 los metabolitos secundarios o especializados se dividen en 3 grupos como terpenoides, compuestos fenólicos, glicósidos y alcaloides, y estos se dividen varias subcategorías (Gara et al., 2018; Bhattacharya Sujata & Puri, 2018). Los compuestos bioactivos son generados
mediante rutas biosintéticas y metabólicas de la planta en respuesta a la interacción con su medio (Deminicis et al., 2021).
Mecanismos de acción
Múltiples investigaciones postulan que los fitobióticos atribuyen una actividad antioxidante. Sin embargo, vastas investigaciones han demostrado que estos compuestos también tienen efectos antiinflamatorios, antimicrobianos, modificadores de la microbiota intestinal, moduladores de la transcripción, mejora-dores de la digestibilidad de los alimentos, entre otros (De et al., 2018; Kikusato, 2021).
Fitobióticos y su acción antimicrobiana
La amplia gama de compuestos bioactivos de los fitobióticos tiene la capacidad de afectar a bacterias, virus, hongos, protozoarios, ácaros, larvas e insecto (Valenzuela-Grijalva et al., 2017), por ejemplo los terpenoides como el mentol, timol, carvacrol, linalol, geraniol, acetato de linalilo) por lo general lo encontramos en los aceites esenciales, son potentes microbicidas (Gessner et al., 2017).
Estos compuestos bioactivos actúan alterando el quorum sensing de las bacterias (segregación de pequeñas moléculas señalizadoras que permiten la intercomunicación entre ellas), de esta manera se evita el desarrollo bacteriano (Bhattacharya Sujata & Puri, 2018). Por otro lado, estas sustancias bioactivas también tienen efecto sobre la síntesis de proteínas, inhibición de síntesis de ATP, reducción del pH intracelular, y cambios en el citoplasma bacteriano, de esta manera se le atribuye un efecto bactericida y bacteriostático (Bastos et al., 2021; Kikusato, 2021).
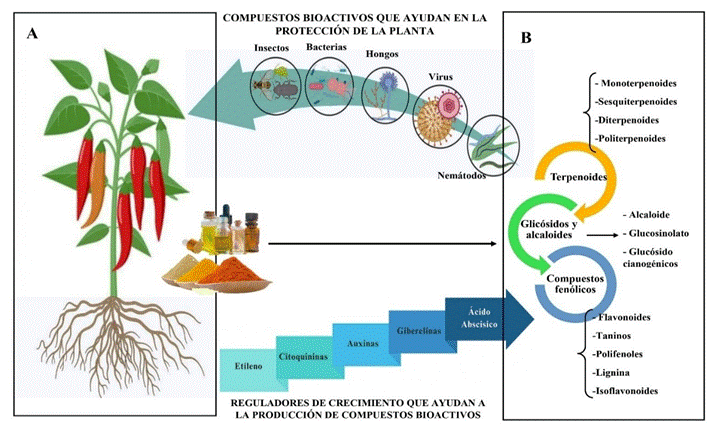
Figura 1.A) Diferentes partes anatómicas de la planta de donde se puede extraer sustancias bioactivas en polvo, aceite esencial o extractos. B) Tipos de metabolitos especializados o compuestos bioactivos que tienen efectos beneficiosos para los animales y los humanos. Fuente: Adaptado de Bhattacharya Sujata & Puri (2018).
Fitobióticos y su efecto antioxidante
En los últimos años, se han reportado una gran cantidad de investigaciones donde reportan que algunos fitobióticos como los flavonoides y los osterpenoides (timol, carvacrol y eugenol) (Bastos et al., 2021), contribuyen en la eliminación de radicales libres (ROS), induciendo a la producción de enzimas antioxidantes como la superóxido dismutasa (Kikusato, 2021). Se ha reportado que la quercetina y el resveratrol son las que activan la vía de Nrf2 (factor de transcripción que regula la expresión de enzimas y proteínas antioxidantes), de esta manera eliminar los ROS (Bhattacharya Sujata & Puri, 2018).
Fitobióticos como promotores de crecimiento
A pesar de que los fitobióticos vienen siendo utilizados hace bastante tiempo como promotores de crecimiento, su mecanismos de acción que lo subyacen aún no han dilucidado por completo Kikusato, (2021); Valenzuela-Grijalva et al, (2017) propusieron 4 principales mecanismos: 1) En función al sabor y tipo de fitobiótico suplementado, se incrementa la ingesta de alimento y estado de la dieta 2) Regula la fermentación ruminal debido a su actividad antimicrobiana., 3) Mejora la función intestinal, por ende optimiza la digestión y absorción de nutrientes. 4) Producir efectos anabólicos directos e indirectos en los tejidos diana activando los sistemas de defensa hormonales y antioxidantes. Esto influye en las características de la canal, mejora de la calidad de la carne y los parámetros de producción, (Voroshilin et al., 2020).
Fitobióticos y su efecto antiinflamatorio
Se ha logrado identificar fitobióticos con capacidad antiinflamatoria, entre ellos destacan el limoneno, α-terpineol, δ-3-careno, α-pineno y 1,8-cineo, estos actúan inhibiendo la liberación de leucotrienos e histamina, así reduce los mediadores inflamatorios como ciclooxigenasa-2 (COX-2) y por ende la liberación de prostaglandina (Bastos et al., 2021). Debido a esta peculiaridad, los fitobióticos son incluidos en la dieta de animales con el objetivo de controlar inflamaciones intestinales causada por diferentes patógenos u otros factores.
Usos y nuevos enfoques de los fitobióticos en la producción animal
En los últimos años la producción animal ha evolucionado en gran medida, en especial el sector avícola y la porcicultura, han tenido un desarrollo poblacional y genético significativo (Mehdi et al., 2018), y unos de sus principales desafíos desde la perspectiva económica e inocuidad, es la alimentación animal (Alkindi et al., 2019). Para garantizar la salud y obtener un máximo rendimiento de los animales, se han utilizado múltiples aditivos nutricionales y no nutricionales (Pandey et al., 2019), entre ellos se tienen a los modificadores de la digestión como (enzimas, minerales y tampones) (Espinosa & Stein, 2021); modificadores del metabolismo (hormonas), antibióticos promotores de crecimiento(APC), probiótico, prebióticos, simbióticos, entre otros (Fathima et al., 2022; Yaqoob et al., 2022; Asif et al., 2022).
Los APC tiene gran influencia en el rendimiento de los animales; sin embargo, se está generando resistencia antimicrobiana (RAM), y tiene efecto residual en los productos de origen animal (Aarestrup & Wegener, 1999), por cuestiones de inocuidad alimentaria cada vez en más países se están restringiendo. Todo esto trae consigo de que se estén optando por el uso de insumos naturales, dentro de estos se encuentra los fitobióticos, (Kikusato, 2021), cabe destacar que falta mucho por investigar en profundidad a los fitobióticos, debido a que están constituidos por complejas y diversas sustancias bioactivas, que independientemente pueden tener igual o distinto efecto en los animales (Alves et al., 2022; Kimminau et al., 2023), múltiples investigaciones reportan que los fitobióticos están siendo empleados de una manera continua, mejorando su rendimiento productivo, la calidad de productos y garantizan su inocuidad (Liebl et al., 2022; Yu et al., 2022), debido a que disminuye la carga patógena mala, aumenta de la secreción de mucosa y tiene efecto sobre las características morfométricas del sistema gastrointestinal, mejora la digestibilidad de los alimentos e incluso actúan como antioxidantes (Rafeeq et al., 2022).
La comunidad científica en su arduo trajo a lo largo de los años han encontrado nuevos productos que cumplen con los estándares de inocuidad y amigables con el ambiente. Como hace constar la Figura 2, en el periodo 2011-2020 existió un crecimiento muy notorio de la producción científica sobre la incorporación de fitobióticos en la producción animal, sin embargo, para el periodo 2021 – 2023 hay un decreciente número de investigaciones, se infiere que las investigaciones van mucho más a fondo, centrándose en los compuestos bioactivos o metabolitos secundarios por lo que sus palabras claves cambian. Siendo los países como India, Brasil, Estados Unidos y China los principales países que más publicaciones tienen referente al tema.
La producción animal es un sector complejo debido a la variedad de animales de interés zootécnico que se cría, por lo consiguiente cada especie indepen-dientemente afronta nuevos problemas y retos tanto en sanidad, alimentación, nutrición, mejora genética y el cambio climático; esto trae consigo a la necesidad de que se investigue muy a detalle el uso de fitobióticos en las diferentes especies, evaluando su efecto positivos y adversos, potencialidades entre otros (Alves et al., 2022; Kimminau et al., 2023).
Se realizó una búsqueda exhaustiva en la base de datos Scopus, los resultados se ven reflejados en la Figura 3 de los diversos artículos publicados en los últimos 10 años sobre el uso de fitoquímicos en diferentes especies como (Aves, porcinos, ovinos, caprinos, bovino, equinos, abejas, cuyes, conejos, equinos y peces) Los criterios de búsqueda correspondieron a los años entre 2014- 2023, título del artículo, resumen, y palabras clave: utilizando las palabras claves (phytobiotics or phytochemicals or plants extracts or herbs extracts or secondary metabolites), palabras asociadas a cada especie con su respectivo nombre científico y con términos de exclusión (human and laboratory mouse) y los referentes a otros temas no relevantes para el estudio.
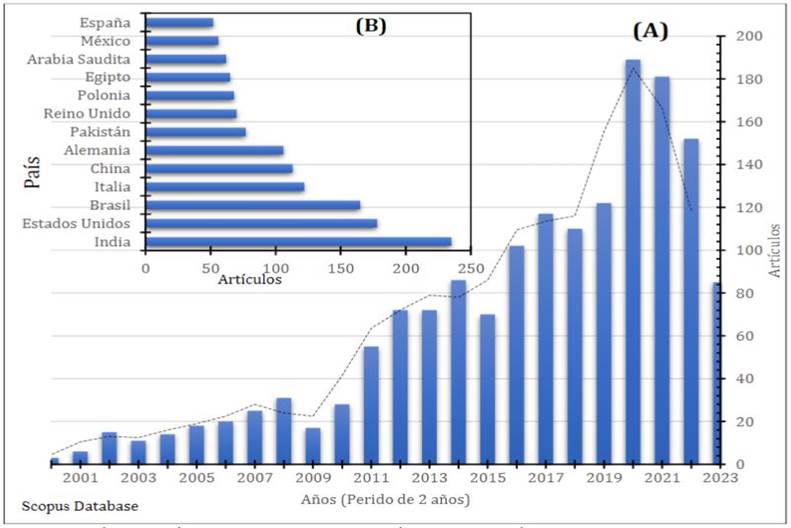
Figura 2: (A) Número de artículos publicados sobre usos de fitobióticos en la producción animal periodo 2000-2023. (B) Principales países que publican referente al uso de fitobióticos en la producción animal periodo 2000 -2023. Datos obtenidos de la base de datos Scopus, con criterios de búsqueda: título del artículo, resumen, y palabras clave: (phytobiotics or phytochemicals or plants extracts or herbs extracts or secondary metabolites and production animals and feeding) con términos de exclusión (human and laboratory mouse).
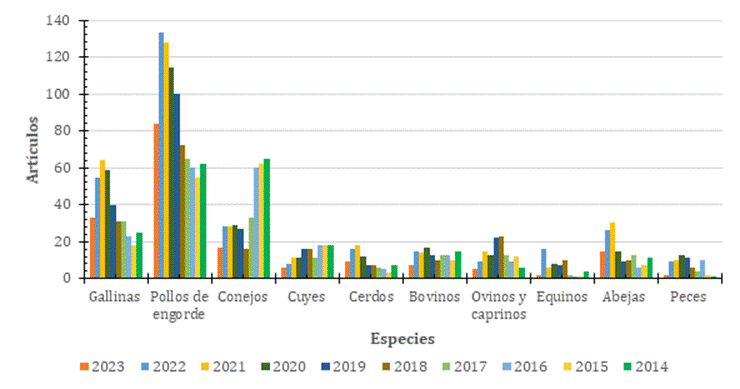 |
Figura 3. Número de artículos publicados sobre el uso de fitobióticos por especies, periodo 2014-2023. Nota: Datos obtenidos de la base de datos Scopus periodo 2014-2023.
Como hace notar la Figura 3, en los últimos 10 años el sector avícola es quien más investiga sobre la incorporación de distintos fitobióticos en su producción, estando en primer lugar la producción de pollo de engorde, le sigue la producción de gallinas ponedoras. También se puede observar que la producción de conejos y abejas tiene una notoria producción científica y le siguen las otras especies. Cabe recalcar que la búsqueda se realizó a mediados del 2023, por lo que se aprecia un breve declive de la producción científica. Los principales resultados de las investigaciones se muestran en las tablas
Tabla 1, 2, 3, 4 y 5.
Uso de fitobióticos en la avicultura
Se estima que para el 2030 el consumo de la carne de aves aumente a 151 831.02 miles de toneladas y en el caso de los huevos a 94 745.81 miles de toneladas a nivel mundial según la Food and Agriculture Organization of the United Nations (FAO, 2021). Si el consumo sigue en ascenso, las producciones avícolas se enfrentará a diversos problemas y retos en sanidad animal e inocuidad (Bamidele et al., 2022; Chen et al., 2019). Por lo que los fitobióticos está siendo utilizado ampliamente en la producción animal, y se reportan resultados tanto favorables y desfavorables, tal como se muestra en la Tabla 1 (Rupasinghe et al., 2010).
Biodisponibilidad
La biodisponibilidad es la proporción (%) del compuesto bioactivo o fitogénico administrado que alcanza la circulación sistémica a través del tracto gastrointestinal después de su ingestión (Lee et al., 2016). Teniendo en cuenta a Gessner et al, (2017), refiere que los fitobióticos tienen una baja biodisponibilidad (Kikusato, 2021), aproximada-mente del 2% al 15% de los compuestos fitobióticos y sus metabolitos pueden ser absorbidos en el intestino delgado. Esto se debe a 4 principales factores.
1) Por lo general los fitobióticos generan ésteres, glucósidos o polímeros; en especial los polifenoles. Los polifenoles para poder ser absorbidos en el intestino delgado tienen que ser hidrolizados a agliconas o glucósido por intermedio de enzimas (lactasa-florizina hidrolasa y β-glucosidasa) o enzimas microbianas porque solo de esta forma pueden absorberse (Gessner et al., 2017; Manach et al., 2004).
2) Si los fitobióticos son administrados como polvo seco de partes de la planta, estos deben ser liberados de su matriz, sin embargo, este proceso puede ser limitados por la falta de enzimas específicas y la cantidad limitada de enzimas microbianas en el intestino (Manach et al., 2004).
3) Los fitobióticos y sus metabolitos se degradan aproximadamente entre 2 a 12 horas post absorción (Manach et al., 2004) y son reconocidos como xenobióticos, en los enterocitos y el hígado sufren modificaciones, como metilación, glucuronidación y sulfatación esto hace que los fitobióticos sean solubles en agua y sean excretados por la orina (Gessner et al., 2017).
4) La entrada de los fitobióticos a los tejidos diana depende de afinidad de unión a la albúmina en la sangre, y esto depende de la estructura química del fitobiótico (Liu et al., 2010), este factor también determina la tasa de eliminación en la sangre.
Investigadores como Cunha Pereira et al. (2020) reportan que ciertas sustancias bioactivas como la nicotina genera una cierta toxicidad en Apis mellifera L y Partamona helleri, también Potrich et al. (2020) expresa que los extractos de Echinodorus grandiflorus, Origanum majorana, Punica granatum y Matricaria chamomilla redujeron la sobrevivencia de las abejas obreras, provocaron cambios morfométricos de las células mesentéricas y del intestino medio. Esto trae consigo a que se sigan investigando mucho más a profundidad la farmacodinámica de los fitobióticos en las diferentes especies (Kikusato, 2021; Oktavia et al., 2017).
Tabla 1
Beneficios del uso de fitobióticos en la avicultura
|
Especie |
Planta |
Compuesto bioactivo o modo de aplicación |
Dosis |
Efecto |
Fuente |
|
Pollos de engorde |
Origanum vulgare y Andrographis paniculata |
Extracto |
10 mg de O, vulgare y 15 mg de Andrographis paniculata por kg de alimento |
Antiparasitario y Promotor de crecimiento - Mayor ganancia de peso - Mejor perfil de microbiota intestinal - Reducción el número de ooquistes |
(Jahja et al., 2023) |
|
Pollos de engorde |
Piper nigrum, Foeniculum vulgare y Curcuma longa |
Aceites esenciales |
1% de cúrcuma, 0,5% de pimienta negra y 0,5% de hinojo |
Promotor de crecimiento - Mayor ganancia de peso - Mayor consumo de alimento - Mayor concentración de hemoglobina |
(Samantaray & Nayak, 2022a) |
|
Pollos de engorde |
No especifica |
Metabolito secundario (berberina) |
1 g/ Kg de alimento |
Promotor de crecimiento - Aumenta la longitud de las vellosidades - Disminuye la profundidad de la cripta e inflamación de linfocitos - Producción de butirato en el ciego - Incremento de bacteria benéfica |
(Dehau et al., 2023) |
|
Pollos de engorde |
Carum carvi L |
No especifica |
10 g/Kg de alimento |
Promotor de crecimiento - Incremento en el tamaño de las vellosidades intestinales y profundidad de cripta - Mayor velocidad de crecimiento - No influye en los perfiles bioquímicos de sangre |
(Šťastník et al., 2022) |
|
Pollos de engorde (Cobb 500) |
Nigella sativa, Trigonella foenum-graecum, y Curcuma longa |
Extracto |
No especifica |
Antibacteriano - Reducción de las bacterias coliformes totales y E. coli |
(Yesuf et al., 2023) |
|
Pollos de engorde |
Brachiaria decumbens |
Polvo de hojas |
25 g/ kg de alimento |
Antiparasitario y Promotor de crecimiento - Aumento de la digestibilidad - Mayor altura de vellosidades - Mejor calidad de carne - Inhibió el crecimiento de E. faecalis |
(Alghirani et al., 2022) |
|
Pollos de engorde |
Sinapis alba, Acorus calamus, Curcuma longa L, |
Fitoanticipinas y fitoalexinas |
60 o 100 mg/kg de composición fitobiótica (PBC) durante 35 días |
- No tiene efecto sobre los parámetros productivos. -Influye significativamente sobre la expresión de miRNAs (miR-30a-5p, miR-181a-5p y miR-206)
|
(Chodkowska et al., 2024) |
|
Pollos de engorde |
S. rarak |
Polvo |
1,25; 2,5; 5 g/kg de alimento |
- Hasta 5 g/ kg de polvo de S. rarak no afecta el peso de la carcasa y órganos viscerales (Corazón, hígado y molleja, longitud del intestino) grasa abdominal |
(Tresia & Pasaribu, 2024) |
|
Gallinas de postura |
Piper nigrum, Foeniculum vulgare y Curcuma longa |
Aceites esenciales |
10 g/Kg de alimento |
Promotor de crecimiento - Aumento de la producción de huevos - Aumento del peso de huevos - Disminución del colesterol de los huevos - Aumento de eficiencia alimenticia |
(Samantaray & Nayak, 2022) |
|
Gallinas ponedoras Lohman-Brown |
Hojas de laurel, cáscara de cebolla y cáscara de ajo |
Extracto |
Combinación de 1,2 ml/día probiótico + 4% fitobiótico |
- Mejoró la condición fisiológica, la histomorfología ileal - Mejora la digestibilidad de la proteína ileal y la conversión alimenticia durante el período posterior al pico de producción |
(Yunianto et al., 2021) |
|
Gallinas ponedoras |
No especifica |
Extracto |
0.0032% de extracto de ajo y 0.0032% de extracto de cebolla |
- Aceleró el inicio de periodo de puesta. - Mejoró la palatabilidad del alimento - Mejor sabor de los huevos cocidos |
(Damaziak et al., 2017) |
|
Gallinas ponedoras |
Zingiber officinale |
Extracto |
100 g/t durante 8 semanas |
Antioxidante - Aumento el peso del huevo, altura de la albúmina y unidad Haugh de los huevos - Disminuyó el contenido de colesterol de la yema - Efecto antioxidante |
(Wen et al., 2019) |
|
Patos de Moscovia |
Andrographis paniculata |
Extracto |
30 g/kg de alimento |
- Mejoró el crecimiento - Mejora del estado inmunológico y la morfología intestinal - Mejora la composición y estructura de la microbiota intestinal |
(Liu et al., 2023) |
Tabla 2
Beneficios del uso de fitobióticos en la crianza de cuyes y conejos
|
Planta |
Compuesto Bioactiva |
Dosis |
Efecto |
Fuente |
|
Cuyes |
||||
|
Curcuma longa |
Flavonoides, alcaloides, taninos, fenoles, esteroides, terpenoides y saponinas |
0.25% por kg de alimento |
- Actividad antimicrobiana - Mejora la ingesta dietética y digestibilidad, digestibilidad de nutrientes |
(Djoumessi et al., 2021) |
|
Dichrostachys glomerata |
Extracto etanólico |
50, 100 y 200 mg/kg de alimento |
- Aumento de número de fetos por madre y fetos viables - Aumento del peso de la placenta - Disminuye el nivel sérico de progesterona - Aumento del peso de los fetos - Reducción del estrés reproductivo |
(Djuissi et al., 2021) |
|
Curcuma longa |
No especifica |
0,25% de Curcuma longa en polvo en la ración |
- Mejora de la tasa de fecundidad (93,3%) - Mayores pesos (77,5 g) al nacimiento y al destete (162 g) |
(Djoumessi et al., 2020) |
|
Conejos |
||||
|
Echinacea purpurea L. |
Polisacáridos, alquilamidas y derivados del ácido cinámico |
1 y 1,5 g por animal al día |
- Mayor velocidad de crecimiento - Mejora las propiedades de calidad de la carne - Mayor retención de humedad y grasa |
(Sergey et al., 2019) |
|
No especifica |
Polisacáridos, alquilamidas y derivados del ácido cinámico |
1,5 g por animal al día |
- Inmunomodulador sobre las células y el organismo en su conjunto - Mejora la composición y parámetros fisicoquímicos de la carne - Aumento de peso y mejora del contenido de proteínas y minerales de la carne |
(Voroshilin et al., 2020) |
|
Lectina de los rizomas de Curcuma longa |
Curcuminoides: curcumina, demetoxicurcumina y bisdeme- toxicurcumina |
No especifica |
- Actividad antifúngica frente: Exserohilum turicicum, Fusarium oxysporum y Colectrotrichum cassiicola - Alta actividad inhibidora de la α-glucosidasa |
(Petnual et al., 2010) |
|
Hoja de Carica papaya |
No especifica |
No especifica |
- Aumento de la digestibilidad - Promueve el funcionamiento digestivo y pulmonar - Actividad antibacteriana, anticoagulante, - antiartritis-reumatoide, antiparasitaria, antiviral, antifúngico, antiinflamatoria, antihipertensiva y antidrepanocítica |
(Jiwuba & Kadurumba, 2019) |
|
Allium sativum |
Flavonoides |
2-6 g/Kg de dieta |
- Mejora el sistema inmune - Reduce la peroxidación de lípidos en el hígado el perfil de lípidos en sangre. - Aumenta la actividad antioxidante hepática |
(Alagawany et al., 2016) |
|
Citratos de Cymbopogon |
β-pireno, linalool, neral, nerol, geraniol, geranial y geranil acetato |
4 g/Kg dieta |
- Incremento de la digestibilidad de la dieta - Mejora el estado antioxidante y la respuesta inmune relativa - Disminuye los neutrófilos (mejor capacidad fagocitaria del sistema inmunitario) |
(Safwat et al., 2021) |
|
Oreganum vulgare |
Carvacrol
|
1% |
- Estimula la secreción de enzimas digestivas - Disminuye la conversión alimenticia |
(Ayala et al., 2011) |
Tabla 3
Beneficios del uso de fitobióticos en producción de porcinos
|
Planta |
Compuesto bioactivo o modo de aplicación |
Dosis |
Efecto |
Fuente |
|
Tinospora cordifolia, Emblica officinalis, Citrus sinensis, Foeniculum vulgare, Andrographis paniculata, Glycyrrhizia glabra, y fibra de nuez |
Aditivos fitogénicos fenólicos |
5 g diarios |
- Reducción del daño oxidativo causado por el estrés por calor. - Mayor rendimiento productivo en cerdas primíparas |
(Papatsiros et al., 2022) |
|
Curcuma longa y Cichorium intybus |
Mezcla fitobióticos más prebióticos de curcumina, germen de trigo y achicoria |
1 kg /tm |
- Disminución de Enterobacteriaceae en un 85 y 88% entre las 3 y 6 semanas de edad. - Aumento de lactobaciláceas en un 29.98 % |
(Juhász et al., 2022; Chang et al., 2022) |
|
Cinamaldehído derivado de la canela |
Manganeso orgánico: 10 g/kg Cinamaldehído: 10 g/kg y Óxido de magnesio: 70 g/kg, |
2,5 kg/ tm |
- No sustituye a la ractopamina - Promueve una carne más suave y menos pálida |
(Moreira et al., 2022) |
|
No especifica |
Tans-Anetol, 1,8-Cineol, Alcanfor, p-Cimeno, D-Limoneno, α-Terpineo, Borneol, α-Pineno, Linaloo, B-Pineno |
1 g / kg de alimento |
- Influye en la histomorfología neonatal - Expresión de genes relacionados con la función y la salud intestinal |
(Moreira et al., 2022) |
|
Psidium guajava |
Extracto de hoja |
50–200 mg / kg de alimento |
- Reduce la incidencia de diarrea - Mayor altura de las microvellosidades intestinales |
(Liu et al., 2023) |
Tabla 4
Beneficios del uso de fitobióticos en rumiantes
|
Especie |
Planta |
Compuesto bioactivo o modo de aplicación |
Dosis |
Efecto |
Fuente |
|
Bovinos (Toros de engorde) |
Col lombarda |
Extracto |
120 g/día |
- Aumentó la concentración ruminal de ácidos grasos volátiles totales - Aumentó las concentraciones plasmáticas de globulina y proteína - Altamente hidrolizable en el fluido ruminal - Modificó ligeramente la comunidad bacteriana del rumen |
(Gao et al., 2022) |
|
Bovinos (Toros de engorde) |
Syzygium aromaticum y Cinnamomum verum |
Harina |
450 mg/kg |
- No logró contrarrestar la oxidación de lípidos de la carne de res |
(Torrecilhas et al., 2021) |
|
Cabras |
Andrographis paniculata |
Extracto de etanol de la hoja |
1125 mg
|
Anticoccidial - Eliminación de coccidia |
(Indrati & Titisari, 2020) |
|
Cabras |
Zingiber officinale, Allium sativum, Artemisia vulgaris, Curcuma longa, Schinopsis balansae |
Extracto |
- 10 g/cabeza/día de taninos - 10 g/cabeza/día de mezcla de hierbas con 25% de inclusión de cada extracto |
-Alteran la microbiota ruminal y maximizan la fermentación ruminal |
(Rabee et al., 2024) |
|
Ovinos y caprinos |
Semilla de uva |
Extracto fenólico |
7,4 g |
- Concentraciones de fenoles en sangre 10% y 17% - Concentraciones de fenoles en leche 32% - La saliva de las cabras tenía una mayor capacidad de unión de taninos que la saliva de las ovejas |
(Leparmarai et al., 2019) |
|
Ovinos y caprinos |
Salix babylonica |
Extracto |
20 ml por animal |
- Disminuye la producción de Eimeria, Cooperia, Chabertia, Dictyocaulus, Moniezia y Ostertagia, Chabertia, y H. contortus |
(Salem et al., 2017) |
|
Ovinos |
Ocimum basilicum |
Planta entera |
Dieta que contenía 25 % de Ocimum basilicum |
- Aumentó la concentración de testosterona y disminuyó los niveles de cortisol en sangre. - Aumentó la concentración, motilidad y viabilidad de los espermatozoides |
(Kosari et al., 2024) |
|
Ovinos |
Castanea sativa |
Taninos |
2 y 4 g de tanino por kg de materia seca |
La dosis de 4 g/kg - Aumentó la ganancia de peso promedio diario - Aumentó el consumo de materia seca - Aumentó la concentración ruminal de ácidos grasos volátiles - Tiene capacidad antioxidante |
(Gao et al., 2024) |
Tabla 5
Beneficios del uso de fitobióticos en abejas, peces y equinos
|
Especie |
Planta |
Compuesto bioactivo o modo de aplicación |
Dosis |
Efecto |
Fuente |
|
Apis mellifera L |
Annona squamosa, Ocimum basilicum, Psidium guajava y Syzygium jambos |
Extracto al 2% de concentración (p/v) |
100 g por 500 ml de etanol |
- Actividad antimicrosporidiana contra Nosema ceranae - Alta toxicidad para las abejas en jaulas de laboratorio, - Mostraron efectos negativos en las abejas en condiciones de colonia completa |
(Chaimanee et al., 2021) |
|
Apis mellifera L y Partamona helleri |
N. tabacum, A. americana y A. colubrina |
Nicotina (8,4–15,1 %), β-cariofileno (11,3 %) y Lupeol (12,2 %) |
No especifica |
- No hay diferencia en el consumo del alimento - El vuelo y la respiración no se ve afectado - La nicotina presenta una cierta toxicidad |
(Cunha et al., 2020) |
|
Apis mellifera L |
Echinodorus grandiflorus, Origanum majorana, Punica granatum y Matricaria chamomilla |
Extracto |
Concentración al 5% |
- Todos los extractos redujeron la sobrevivencia de las abejas obreras - Los extractos vegetales de O. majorana y P. granatum provocaron cambios morfométricos de las células mesentéricas - El extracto de O. majorana mostró un efecto negativo sobre la morfometría de las células del intestino medio. |
(Potrich et al., 2020) |
|
Apis mellifera L |
Calamintha sylvatica Bromf, Mentha piperita L, Lavandula austroapennina, Calamintha nepeta Savi, |
Aceites esenciales |
2, 1 y 0,5 mg/ml |
- Actividad acaricida contra Varroa |
(Bava et al., 2024) |
|
Pangasianodon hypophthalmus (Acuicultura) |
Ginkgo biloba, Moringa oleífera, Myristica fragrans, Silybum marianum y Astragalus membranaceus |
Extracto |
Inclusión de cada extracto (1,0 y 2,0 g/kg) |
- Mayor velocidad de crecimiento - Aumento de las actividades de proteínas séricas - Aumento de los niveles de inmunoglobulina total - Mejora significativamente el crecimiento, la inmunidad de los alevines de P. hypophthalmus |
(Abd-elaziz et al., 2023) |
|
trucha arco iris (Oncorhynchus mykiss) |
Verbena de limón (Aloysia triphylla) |
Extracto |
7 g/kg de alimento |
- Mejora el rendimiento del crecimiento y los parámetros de inmunidad no específicos |
(Adeli et al., 2021) |
|
Tilapia |
Cyperus rotundus Linn |
Extracto |
0.4; 08 y 1.6 g/kg durante 60 días |
La dosis de 0,8 g/kg de alimento tuvo los mejores resultados. - Aumento en la ganancia de peso - Menor índice de conversión alimenticia - -Tendencia a la resistencia a S. agalactiae |
(Wigraiboon et al., 2024) |
|
Equinos ( Mini Horse castrados) |
Macleaya cordata |
Extracto |
1.5 mg/kg/ Pv 2 mg/kg/ Pv |
- Mejora la digestibilidad aparen de del extracto etéreo - Aumento de la concentración de Isovalerato - Mayores valores de butirato |
(Medeiros et al., 2023) |
|
Equinos |
Macleaya cordata |
Extracto |
1.5 mg/kg/ Pv 2 mg/kg /Pv |
- La dosis segura para caballos es hasta dosis de 2 mg/kg/Pv - No se encontraron efectos antiinflamatorios sistémicos |
(Ferreira et al., 2023) |
|
Estudio in vitro utilizando heces de caballo |
Azadirachta indica y Cnidoscolus angustidens, |
Extractos acuosos |
0,6, 1,2 y 1,8 ml |
- Efecto positivo en la reducción de la producción de gases de efecto invernadero - Mejoran la concentración de ácidos grasos de cadena corta - No tienen efecto nocivo en la actividad microbiana |
(Alvarado et al., 2022) |
Desafíos actuales y futuros de los fitobióticos en la producción animal
Los fitobióticos presentan complejas estructuras químicas y moleculares, es así como factores extrínsecos como la temperatura, luz, tiempo, humedad, oxígeno, metales, entre otros (Manach et al., 2004), y factores intrínsecos en el animal como la temperatura, pH intestinal, actividad enzimática y actividad bacteriana, que pueden afectar la estabilidad y biodisponibilidad, haciendo que sean menos eficientes y eficaces (Gessner et al., 2017). Favorablemente, existen diferentes tecnologías y métodos como la microencapsulación, nanoen-capsulación y el sinergismo con otras sustancias que buscan garantizar su estabilidad y biodisponibilidad (Pandit et al., 2016; Rosales-López et al., 2019; Yesuf et al., 2023). Desde otra perspectiva, un desafío muy preocupante es la extinción de plantas de alto potencial de compuestos bioactivos (Rosales-López et al., 2019). El quinto informe sobre el Estado Mundial de las Plantas y los Hongo 2023 elaborado por el Real Jardín Botánico de Kew (Londres), reporta que a existe un sinnúmero de plantas que están en vías de peligro de extinción, incluyendo plantas de alto potencial de compuestos bioactivos, entre ellos se puede mencionar a Artemisia granatensis, Crocus serotinus, Abedul fontqueri, Maytenus ilicifolia, Magnolia dealbata, entre otras (Antonelli et al., 2023).
CONCLUSIONES
Los fitobióticos desempeñan un rol importante en la producción de animales domésticos, dado que cumplen con los estándares y normativas de inocuidad alimentarias, representan una alternativa prometedora para la reducción del uso de antibiótico promotores de crecimiento (APC); los fitobióticos van mucho más allá, ya que funcionan como antioxidante, antiinflamatorio, antimicrobiano, promotor de crecimiento, reductores en la producción de gases de efecto invernadero y mejoradores de las características organolépticas de los alimentos. Todo esto se debe a que están constituido por una gama de compuestos bioactivos que independientemente o en conjunto tienen diferentes efectos. Si embargo dado esta característica, los fitobióticos presentan ciertas limitaciones, como su biodisponibilidad, estabilidad o generar efectos adversos por el desconocimiento de su farmacodinámica. Esto trae consigo a la necesidad de seguir investigando más a profundidad sobre los fitobióticos, dado que en el mundo existe una diversidad de plantas y algunas con alto potencial fitogénico.
REFERENCIAS BIBLIOGRÁFICAS
Aarestrup, F. M., & Wegener, H. C. (1999). The effects of antibiotic usage in food animals on the development of antimicrobial resistance of importance for humans in Campylobacter and Escherichia coli. Microbes and Infection, 1(8), 639-644. https://doi.org/10.1016/S1286-4579(99)80064-1
Abd-elaziz, R. A., Shukry, M., Abdel-Latif, H. M. R., & Saleh, R. M. (2023). Growth-promoting and immunostimulatory effects of phytobiotics as dietary supplements for Pangasianodon hypophthalmus fingerlings. Fish & Shellfish Immunology, 133, 108531. https://doi.org/10.1016/j.fsi.2023.108531
Adeli, A., Shamloofar, M., & Akrami, R. (2021). Dietary effect of Lemon Verbena ( Aloysia triphylla ) extract on growth performance, some haematological, biochemical, and non-specific immunity and stocking density challenge of rainbow trout juveniles (Oncorhynchus mykiss). Journal of Applied Animal Research, 49(1), 382-390. https://doi.org/10.1080/09712119.2021.1990069
Alagawany, M., Ashour, E. A., & Reda, F. M. (2016). Effect of Dietary Supplementation of Garlic (Allium Sativum) and Turmeric (Curcuma Longa) on Growth Performance, Carcass Traits, Blood Profile and Oxidative Status in Growing Rabbits. Annals of Animal Science, 16(2), 489-505. https://doi.org/10.1515/AOAS-2015-0079
Alghirani, M. M., Chung, E. L. T., Kassim, N. A., Ong, Y. L., Jesse, F. F. A., Sazili, A. Q., & Loh, T. C. (2022). Effect of Brachiaria decumbens as a novel supplementation on the production performance of broiler chickens. Tropical Animal Health and Production, 54(6), 1-14. https://doi.org/10.1007/S11250-022-03384-4/METRICS
Alkindi, F. F., Yulia, R., Herawati, F., & Jaelani, A. K. (2019). Influence of historical use of antibiotics toward antibiotic resistance. Farmasains : Jurnal Farmasi dan Ilmu Kesehatan, 4(1), 9. https://doi.org/10.22219/FARMASAINS.V4I1.7901
Alvarado, T. D., Elghandour, M. M. M. Y., Ekanem, N. J., Alcala-Canto, Y., Velázquez, A. E., Pacheco, E. B. F., Purba, R. A. P., & Salem, A. Z. M. (2022). Influence of Azadirachta indica and Cnidoscolus angustidens Dietary Extracts on Equine Fecal Greenhouse Gas Emissions. Journal of Equine Veterinary Science, 116, 104049. https://doi.org/10.1016/j.jevs.2022.104049
Alves, V. V., Arantes, L. C. R. V., de Barros Moreira Filho, A. L., da Silva Teixeira, M., da Silva, E. F. A., de Mesquita Souza Saraiva, M., de Lucena, R. B., Givisiez, P. E. N., de Oliveira, C. J. B., & de Freitas Neto, O. C. (2022). Effect of diets containing commercial bioactive compounds on Salmonella Heidelberg infection in broiler chicks. Brazilian Journal of Microbiology, 54(1), 571-577. https://doi.org/10.1007/S42770-022-00899-8
Antonelli, A., Fry, C., Smith, R., Simmonds, M., Kersey, P., Pritchard, H., Abbo, M., Acedo, C., Adams, J., Ainsworth, A., Allkin, B., Annecke, W., Bachman, S., Bacon, K., Bárrios, S., Barstow, C., Battison, A., Bell, E., Bensusan, K., & Zhang, B. (2023). State of the World’s Plants and Fungi 2023. Royal Botanic Gardens, Kew. https://www.kew.org/science/state-of-the-worlds-plants-and-fungi
Ayala, D., Peralvo Vidal, J., Madril, K., & Burgos Mayorga, A. (2022). Suplementos alimenticios en porcicultura como alternativa a los antibióticos. AlfaPublicaciones, 4(3), 39-65. https://doi.org/10.33262/ap.v4i3.222
Ayala, Silvana, N., Zocarrato, I., & Sarai. (2011). Uso de orégano vulgar (Origanum vulgare) como fitobiótico en el engorde de conejos. Cuban Journal of Agricultural Science, 45(2). https://cjascience.com/index.php/CJAS/article/view/136
Bamidele, O., Yakubu, A., Joseph, E. B., & Amole, T. A. (2022). Antibiotic Resistance of Bacterial Isolates from Smallholder Poultry Droppings in the Guinea Savanna Zone of Nigeria. Antibiotics, 11(7), 973. https://doi.org/10.3390/antibiotics11070973
Bastos, A. J., Valdiviezo, M. J., Silva, C. A., Ana, P., & Rodrigues, L. B. F. (2021). O outro lado dos ácidos orgânicos e fitogênicos. Pubvet, 15(06), 1-8. https://doi.org/10.31533/PUBVET.V15N06A837.1-8
Bava, R., Castagna, F., Lupia, C., Ruga, S., Conforti, F., Marrelli, M., Argentieri, M. P., Musella, V., Britti, D., Statti, G., Statti, G., & Palma, E. (2024). Phytochemical Composition and Pharmacological Efficacy Evaluation of Calamintha nepeta, Calamintha sylvatica, Lavandula austroapennina and Mentha piperita Essential Oils for the Control of Honeybee (Apis mellifera) Varroosis. Animals, 14(1). https://doi.org/10.3390/ani14010069
Bhattacharya Sujata, J. K., & Puri, S. (2018). Plant growth regulator mediated consequences of secondary metabolites in medicinal plants. Journal of Applied Research on Medicinal and Aromatic Plants, 9, 26–38. https://doi.org/10.1016/j.jarmap.2017.12.003
Buenaño, H. C. X., & Sánchez, L. R. B. (2022). Uso del jengibre (Zinger officinale) y cúrcuma (Curcuma longa) como aditivos fitobioticos en lechones posdestete. Revista Arbitrada Interdisciplinaria Koinonía, 7(14), 32-43. https://doi.org/10.35381/r.k.v7i14.1853
Caicedo, W., Margoth Chinque Deisy, & Jimena Grefa Vanessa. (2022). Aditivos fitobióticos y su efecto en el comportamiento productivo de los cerdos. Revista Cubana de Ciencias Agropecuarias, 56(2).
Chaimanee, V., Kasem, A., Nuanjohn, T., Boonmee, T., Siangsuepchart, A., Malaithong, W., Sinpoo, C., Disayathanoowat, T., & Pettis, J. S. (2021). Natural extracts as potential control agents for Nosema ceranae infection in honeybees, Apis mellifera. Journal of Invertebrate Pathology, 186, 107688. https://doi.org/10.1016/j.jip.2021.107688
Chodkowska, K. A., Barszcz, M., & Tuśnio, A. (2024). MicroRNA expression and oxidative stress markers in pectoral muscle of broiler chickens fed diets supplemented with phytobiotics composition. Scientific Reports, 14(1). https://doi.org/10.1038/s41598-024-54915-y
Costa, L. B., Berenchtein, B., Almeida, V. V., Tse, M. L. P., Braz, D. B., Andrade, C., Mourão, G. B., & Miyada, V. S. (2011). Aditivos fitogênicos e butirato de sódio como promotores de crescimento de leitões desmamados. Archivos de Zootecnia, 60(231), 687-698. https://doi.org/10.4321/S0004-05922011000300056
Cunha Pereira, R., Faria Barbosa, W., Pereira Lima, M. A., Vieira, J. O. L., Carvalho Guedes, R. N., Rodrigues da Silva, B. K., Dias Barbosa, G. M., & Lemes Fernandes, F. (2020). Toxicity of botanical extracts and their main constituents on the bees Partamona helleri and Apis mellifera. Ecotoxicology, 29(3), 246-257. https://doi.org/10.1007/s10646-020-02167-7
Damaziak, K., Riedel, J., Gozdowski, D., Niemiec, J., Siennicka, A., & Róg, D. (2017). Productive performance and egg quality of laying hens fed diets supplemented with garlic and onion extracts. Journal of Applied Poultry Research, 26(3), 337-349. https://doi.org/10.3382/japr/pfx001
Dehau, T., Cherlet, M., Croubels, S., van Immerseel, F., & Goossens, E. (2023). A High Dose of Dietary Berberine Improves Gut Wall Morphology, Despite an Expansion of Enterobacteriaceae and a Reduction in Beneficial Microbiota in Broiler Chickens. mSystems, 8(1). https://doi.org/10.1128/msystems.01239-22
Deminicis, R. G. da S., Meneghetti, C., Oliveira, E. B. de, Garcia Júnior, A. A. P., Farias Filho, R. V., & Deminicis, B. B. (2021). Systematic review of the use of phytobiotics in broiler nutrition. Revista de Ciências Agroveterinárias, 20(1), 098-106. https://doi.org/10.5965/223811712012021098
Djoumessi, G. F. T., Tendonkeng, F., Miégoué, E., Camara, S., Fokom Wauffo, D., Emalé, C., & Pamo, T. E. (2020). Effect of different levels of curcuma longa powder in the diet on reproductive and growth performance of Guinea pigs. Livestock Research for Rural Development, 32(6). https://lrrd.cipav.org.co/lrrd32/6/ftend32088.html
Djoumessi, G. F. T., Tendonkeng, F., Miegoue, E., Emale, C., Wauffo, D. F., & Hornick, J. L. (2021). Effects of graded levels of Curcuma longa Powder on in vivo digestibility in Guinea pigs (Cavia porcellus). Tropicultura, 39(3), 1-11. https://doi.org/10.25518/2295-8010.1847
Djuissi, N. M., Ngoula, F., Kouamo, J., Vemo, N. B., Nono, M. F. S., Lontio, A. F., Tchoffo, H., & Dongmo, A. N. (2021). Reproductive Characteristics, Serum Metabolites, and Oxidative Status in Female Guinea Pigs (Cavia porcellus) Fed with Ethanolic Extract of Dichrostachys glomerata Fruit. World’s Veterinary Journal, 11(1), 66-72. https://doi.org/10.54203/scil.2021.wvj9
Espinosa, C. D., & Stein, H. H. (2021). Digestibility and metabolism of copper in diets for pigs and influence of dietary copper on growth performance, intestinal health, and overall immune status: a review. Journal of Animal Science and Biotechnology 2021 12:1, 12(1), 1-12. https://doi.org/10.1186/S40104-020-00533-3
Fathima, S., Shanmugasundaram, R., Adams, D., & Selvaraj, R. K. (2022). Gastrointestinal Microbiota and Their Manipulation for Improved Growth and Performance in Chickens. Foods, 11(10), 1401. https://doi.org/10.3390/FOODS11101401
Ferreira, J. R. de M., Ferraz, P. A., da Silva, A. H., Pugliesi, G., & Gobesso, A. A. de O. (2023). Macleaya cordata extract phytogenic additive: A safe alternative for horses that influences intestinal wall thickness. Livestock Science, 275, 105290. https://doi.org/10.1016/j.livsci.2023.105290
Food and Agriculture Organization of the United Nations (FAO). (2021). OECD-FAO Agricultural Outlook 2021-2030. OECD. https://doi.org/10.1787/19428846-en
Gao, C., Qi, M., & Zhou, Y. (2024). Chestnut tannin extract modulates growth performance and fatty acid composition in finishing Tan lambs by regulating blood antioxidant capacity, rumen fermentation, and biohydrogenation. BMC Veterinary Research, 20(1). https://doi.org/10.1186/s12917-023-03870-3
Gao, J., Cheng, B. B., Liu, Y. F., Li, M. M., & Zhao, G. Y. (2022). Effects of red cabbage extract rich in anthocyanins on rumen fermentation, rumen bacterial community, nutrient digestion, and plasma indices in beef bulls. animal, 16(5), 100510. https://doi.org/10.1016/j.animal.2022.100510
Gara, L., Orsin, F., Nicoletti, I., & Corradini, D. (2018). Aspectos Fundamentales y Prácticos de la Cromatografía Líquida y Técnicas de Electromigración Capilar para el Análisis de Compuestos Fenólicos en Plantas y Alimentos Derivados de Plantas, Parte 1: Cromatografía Líquida. LCGC Europa, 31(9), 480-490.
Gessner, D. K., Ringseis, R., & Eder, K. (2017). Potential of plant polyphenols to combat oxidative stress and inflammatory processes in farm animals. Journal of Animal Physiology and Animal Nutrition, 101(4), 605-628. https://doi.org/10.1111/jpn.12579
Hidanah, S., Sabdoningrum, E. K., Al Arif, M. A., Ansori, A. N. M., Hasanah, T. P., & Widaya, L. V. A. (2020). Sambiloto (Andrographis paniculata) Extract Improves the Performance of Animal Model Infected with Escherichia coli. Indian Journal of Forensic Medicine & Toxicology. 14(4) 3491-3496, https://doi.org/10.37506/ijfmt.v14i4.12167
Honorio-Javes, C. E., Vallenas-Sánchez, Y., Bazán Pérez, J. T., Antenor Orrego Trujillo, P., Av América Sur, P., & Monserrate, urb. (2021). Coctel de bacteriófagos como sustituto de promotores de crecimiento tipo antibiótico en avicultura. Scientia Agropecuaria, 12(4), 499-508. https://doi.org/10.17268/sci.agropecu.2021.054
Hu, N.-X., Chen, M., Liu, Y.-S., Shi, Q., Yang, B., Zhang, H.-C., Cheng, P., Tang, Q., Liu, Z.-Y., & Zeng, J.-G. (2019). Pharmacokinetics of sanguinarine, chelerythrine, and their metabolites in broiler chickens following oral and intravenous administration. Journal of Veterinary Pharmacology and Therapeutics, 42(2), 197-206. https://doi.org/10.1111/jvp.12729
Indrati, R., & Titisari, N. (2020). The Effectiveness of Phytopharmaca of Ethanol Extract Sambiloto Leaf as an Alternative of Control to Coccidiosis. IOP Conference Series: Earth and Environmental Science, 478(1), 012083. https://doi.org/10.1088/1755-1315/478/1/012083
Jahja, E. J., Yuliana, R., Simanjuntak, W. T., Fitriya, N., Rahmawati, A., & Yulinah, E. (2023). Potency of Origanum vulgare and Andrographis paniculata extracts on growth performance in poultry. Veterinary and Animal Science, 19, 100274. https://doi.org/10.1016/j.vas.2022.100274
Jiwuba, P. D. C., & Kadurumba, O. E. (2019). Nutritional and phytogenic properties of pawpaw (Carica papaya) leaf meal on blood characteristics of growing rabbits. Acta Fytotechnica et Zootechnica, 22(2), 46-51. https://doi.org/10.15414/AFZ.2019.22.02.46-51
Juhász, Á., Molnár-Nagy, V., Bata, Z., Tso, K. H., Mayer, Z., & Posta, K. (2022). Alternative to ZnO to establish balanced intestinal microbiota for weaning piglets. PLoS ONE, 17(3). https://doi.org/10.1371/JOURNAL.PONE.0265573
Kikusato, M. (2021). Phytobiotics to improve health and production of broiler chickens: functions beyond the antioxidant activity. Animal Bioscience, 34(3), 345-353. https://doi.org/10.5713/ab.20.0842
Kimminau, E. A., Karnezos, T. P., Ko, H., Fasina, Y., & Kim, W. K. (2023). Phytogenic blend administered through water impacts Salmonella infection in broiler chickens. Journal of Applied Poultry Research, 32(1), 100320. https://doi.org/10.1016/J.JAPR.2022.100320
Kosari, G., Norouzian, M. A., Khorrami, B., & Najafi, A. (2024). Effects of dietary basil (Ocimum basilicum) supplementation on reproductive hormones, semen parameters, and testicular development in Zandi male lambs. Veterinary and Animal Science, 23. https://doi.org/10.1016/j.vas.2024.100338
Lee, M. T., Lin, W. C., Yu, B., & Lee, T. T. (2016). Antioxidant capacity of phytochemicals and their potential effects on oxidative status in animals — A review. Asian-Australasian Journal of Animal Sciences, 30(3), 299-308. https://doi.org/10.5713/ajas.16.0438
Leonor, L., López, A., Yadmila, L., Gala, D., Michell, L., Tabío, T., Sheyla Fernández, L., & Ii, P. (2017). Los enzibióticos como alternativa terapéutica contra las enfermedades bacterianas. MEDISAN, 21(10), 3077-3083. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1029-30192017001000012&lng=es&nrm=iso&tlng=es
Leparmarai, P. T., Sinz, S., Kunz, C., Liesegang, A., Ortmann, S., Kreuzer, M., & Marquardt, S. (2019). Transfer of total phenols from a grapeseed-supplemented diet to dairy sheep and goat milk, and effects on performance and milk quality1. Journal of Animal Science, 97(4), 1840-1851. https://doi.org/10.1093/jas/skz046
Liebl, M., Gierus, M., Rocchi, E., Potthast, C., & Schedle, K. (2022). Effects of energy reduced diets including alternative protein sources and a phytogenic supplement on performance, carcass traits and digestibility in broiler chickens. Journal of Applied Poultry Research, 31(3), 100265. https://doi.org/10.1016/J.JAPR.2022.100265
Liu, E.-H., Qi, L.-W., & Li, P. (2010). Structural Relationship and Binding Mechanisms of Five Flavonoids with Bovine Serum Albumin. Molecules, 15(12), 9092-9103. https://doi.org/10.3390/molecules15129092
Liu, Z., Lei, X., Li, J., Zhong, Y., Tan, D., Zhang, Q., & Kong, Z. (2023). Effects of fermented Andrographis paniculata on growth performance, carcass traits, immune function, and intestinal health in Muscovy ducks. Poultry Science, 102(3), 102461. https://doi.org/10.1016/j.psj.2022.102461
Manach, C., Scalbert, A., Morand, C., Rémésy, C., & Jiménez, L. (2004). Polyphenols: food sources and bioavailability. The American Journal of Clinical Nutrition, 79(5), 727-747. https://doi.org/10.1093/ajcn/79.5.727
Medeiros, F. J. R., Mello Cerbaro, A. E., Bastos, F. L., Pereira, R. A., Duarte, M. A., Araújo Júnior, Â. M. C., da Silva, A. H., & de Oliveira Gobesso, A. A. (2023). Effects of Macleaya cordata extract supplementation on digestive parameters of ponies. Archives of Animal Nutrition, 77(2), 110-120. https://doi.org/10.1080/1745039X.2023.2187198
Mehdi, Y., Létourneau-Montminy, M. P., Gaucher, M. Lou, Chorfi, Y., Suresh, G., Rouissi, T., Brar, S. K., Côté, C., Ramirez, A. A., & Godbout, S. (2018). Use of antibiotics in broiler production: Global impacts and alternatives. Animal Nutrition, 4(2), 170-178. https://doi.org/10.1016/J.ANINU.2018.03.002
Miranda, V. M. de M. C., Silva, L. A. L. da, Leite, S. M., Ribeiro, B. L., Batista, P. R., Silva, E. M. T. T. da, & Castilha, L. D. (2021). Phytogenic compounds and bioactive substances for rabbits: benefits on reproduction, well-being and meat quality. Research, Society and Development, 10(12), e306101220103–e306101220103. https://doi.org/10.33448/RSD-V10I12.20103
Moreira, V. dos S., Garbossa, C. A. P., Guimarães, E. B. B., Hirai, W. Y., da Cruz, T. A., Alves, L. K. S., & Araujo, L. F. (2022). Evaluation of a Phytogenic Compound with Minerals as a Possible Alternative to Ractopamine for Finishing Pigs. Animals 12(18), 2311. https://doi.org/10.3390/ANI12182311
Oktavia, A. I., Batoro, J., & Indriyani, S. (2017). Phytochemical and Histochemical Screening of Toxic Plant Based on Knowledge of Tengger Tribe in Ngadiwono Village, Pasuruan. The Journal of Experimental Life Sciences, 7(1), 50-54. https://doi.org/10.21776/ub.jels.2016.007.01.10
Pandey, A. K., Kumar, P., & Saxena, M. J. (2019). Feed Additives in Animal Health. Nutraceuticals in Veterinary Medicine, 345-362. https://doi.org/10.1007/978-3-030-04624-8_23
Pandit, J., Aqil, Mohd., & Sultana, Y. (2016). Nanoencapsulation technology to control release and enhance bioactivity of essential oils. En Encapsulation.12(1) 597-640. https://doi.org/10.1016/B978-0-12-804307-3.00014-4
Papatsiros, V. G., Katsogiannou, E. G., Papakonstantinou, G. I., Michel, A., Petrotos, K., & Athanasiou, L. V. (2022). Effects of Phenolic Phytogenic Feed Additives on Certain Oxidative Damage Biomarkers and the Performance of Primiparous Sows Exposed to Heat Stress under Field Conditions. Antioxidants, 11(3), 593. https://doi.org/10.3390/ANTIOX11030593/S1
Petnual, P., Sangvanich, P., & Karnchanatat, A. (2010). A lectin from the rhizomes of turmeric (Curcuma longa L.) and its antifungal, antibacterial, and α-glucosidase inhibitory activities. Food Science and Biotechnology, 19(4), 907-916. https://doi.org/10.1007/s10068-010-0128-5
Potrich, M., Silva, R. T. L. da, Maciel, R. M. A., Costa-Maia, F. M., Lozano, E. R., Rossi, R. M., Martins, J. R., & Dallacort, S. (2020). Are plant extracts safe for honey bees ( Apis mellifera) ? Journal of Apicultural Research, 59(5), 844-851. https://doi.org/10.1080/00218839.2020.1735733
Rabee, A. E., Mohamed M. Ghandour, M., Sallam, A., Elwakeel, E. A., Mohammed, R. S., Sabra, E. A., Abdel-Wahed, A. M., Mourad, D. M., Hamed, A. A., & Hafez, O. R. (2024). Rumen fermentation and microbiota in Shami goats fed on condensed tannins or herbal mixture. BMC Veterinary Research, 20(1). https://doi.org/10.1186/s12917-024-03887-2
Rafeeq, M., Bilal, R. M., Alagawany, M., Batool, F., Yameen, K., Farag, M. R., Ali, S., Elnesr, S. S., & El-Shall, N. A. (2022). The use of some herbal plants as effective alternatives to antibiotic growth enhancers in poultry nutrition. World’s Poultry Science Journal, 78(4), 1067–1085. https://doi.org/10.1080/00439339.2022.2108362
Rosabal, N. O., Martínez, A. Y., Rodríguez, B. R., Pupo Torres, G., Olmo, G. C., & Más, T. D. (2017). Efecto de la suplementación dietética del polvo de hojas de Anacardium occidentale L. (marañón) en la producción y calidad del huevo de gallinas ponedoras. Revista Cubana de Plantas Medicinales, 22(1), 0-0.
Rosales-López, C., Arnáez-Serrano, E., Moreira- González, I., Garro-Monge, G., Agüero-Hernández, A. L., Jiménez-Quesada, K., Abdelnour-Esquivel, A., & Calvo-Castro, L. (2019). Investigaciones en plantas con potencial bioactivo. Revista Tecnología en Marcha, 32(9), 12–21. https://doi.org/10.18845/tm.v32i9.4621
Rupasinghe, H. V., Ronalds, C. M., Rathgeber, B., & Robinson, R. A. (2010). Absorption and tissue distribution of dietary quercetin and quercetin glycosides of apple skin in broiler chickens. Journal of the Science of Food and Agriculture, 90(7), 1172-1178. https://doi.org/10.1002/jsfa.3944
Salem, A. Z. M., Elghandour, M. M. Y., Kholif, A. E., López, S., Pliego, A. B., Cipriano-Salazar, M., Chagoyán, J. C. V., de Oca Jiménez, R. M., & Alonso, M. U. (2017). Tree leaves of Salix babylonica extract as a natural anthelmintic for small-ruminant farms in a semiarid region in Mexico. Agroforestry Systems, 91(1), 111-122. https://doi.org/10.1007/s10457-016-9909-z
Samantaray, L., & Nayak, Y. (2022a). Influence of Phytobiotic Essential Oils on Growth Performance and Hematological Parameters of Broiler Chickens. Advances in Animal and Veterinary Sciences, 10(6), 1189-1422 https://doi.org/10.17582/journal.aavs/2022/10.6.1289.1295
Samantaray, L., & Nayak, Y. (2022b). The Influences of Black Pepper, Turmeric and Fennel Essential Oils Supplementation in Feed on Egg Quality Characteristics of Layers. Journal of Animal Health and Production, 10(4). https://doi.org/10.17582/journal.jahp/2022/10.4.522.528
Sánchez-Torres, M. T., Cordero-Mora, J. L., Martinez-Aispuro, J. alfredo, Mendoza- Martínez, G. D., Ayala-Monter, M. A., Vázquez-Silva, G., Hernández-García, P. A., & Figueroa-Velasco, J. L. (2022). Adición de un fitogénico poliherbal en dietas de corderos de engorda. Ecosistemas y Recursos Agropecuarios, 9(2). https://doi.org/10.19136/era.a9n2.3125
Sergey, R.M; Gennadyevna, K; Roman, A. V; y Ulrikh V. E. (2019). Efecto de los aditivos fitobióticos para piensos a base de extracto de agua-etanol de Echinacea Purpurea sobre las características cualitativas de la carne de conejo. Journal of Advanced Pharmacy Education and Research, 9(5). https://japer.in/article/effect-of-phytobiotic-fodder-additives-based-on-water-ethanol-extract-of-echinacea-purpurea-on-the-qualitative-characteristics-of-rabbit-meat
Šťastník, O., Novotný, J., Roztočilová, A., Zálešáková, D., Řiháček, M., Horáková, L., Pluháčková, H., Pavlata, L., & Mrkvicová, E. (2022). Caraway (Carum carvi L.) in fast-growing and slow-growing broiler chickens’ diets and its effect on performance, digestive tract morphology and blood biochemical profile. Poultry Science, 101(9), 101980. https://doi.org/10.1016/j.psj.2022.101980
Torrecilhas, J. A., Ornaghi, M. G., Passetti, R. A. C., Mottin, C., Guerrero, A., Ramos, T. R., Vital, A. C. P., Sañudo, C., Malheiros, E. B., & Prado, I. N. do. (2021). Meat quality of young bulls finished in a feedlot and supplemented with clove or cinnamon essential oils. Meat Science, 174, 108412. https://doi.org/10.1016/j.meatsci.2020.108412
Tresia, G. E., & Pasaribu, T. (2024). Evaluación de canales y órganos viscerales de pollos de engorde infectados con Eimeria tenella con suplementación en polvo de Lerak (Sapindus rarak). Actas de La Conferencia AIP, 3055, 070011. https://doi.org/10.1063/5.0184116
Valenzuela-Grijalva, N. V., Pinelli-Saavedra, A., Muhlia-Almazan, A., Domínguez-Díaz, D., & González-Ríos, H. (2017). Dietary inclusion effects of phytochemicals as growth promoters in animal production. Journal of Animal Science and Technology, 59(1), 8. https://doi.org/10.1186/s40781-017-0133-9
Voroshilin, R. A., Kurbanova, M. G., Rassolov, S. N., & Ulrikh, E. V. (2020). Rabbit dietary supplementation with echinacea purpurea l.: The quality profile of rabbit meat. Food Processing: Techniques and Technology, 50(2), 185-193. https://doi.org/10.21603/2074-9414-2020-2-185-193
Wen, Gu, Tao, Cheng, Wang, & Zhou. (2019). Effects of Ginger Extract on Laying Performance, Egg Quality, and Antioxidant Status of Laying Hens. Animals, 9(11), 857. https://doi.org/10.3390/ani9110857
Wigraiboon, S., Panchan, R., Luang-In, V., Ounjit, W., Panase, P., Sookying, S., & Sutthi, N. (2024). Effects of Dietary Tuber Ethanolic Extract of Nut Grass (Cyperus rotundus Linn.) on Growth, Immune Response, and Disease Resistance in Nile Tilapia (Oreochromis niloticus). Animals, 14(3). https://doi.org/10.3390/ani14030503
Yesuf, Y. K., Tamir, B., Tesfaye, E., & Beyero, N. (2023). The synergetic effects of some phytobiotics mix on growth, hematology and microbial loads of broiler chickens. Animal Biotechnology, 34(8), 1-7. https://doi.org/10.1080/10495398.2023.2165934
Yu, S. J., Bajagai, Y. S., Petranyi, F., & Stanley, D. (2022). Phytogen Improves Performance during Spotty Liver Disease by Impeding Bacterial Metabolism and Pathogenicity. Applied and Environmental Microbiology, 88(18).
Yunianto, V. D., Sukamto, B., Sugiharto, S., & Hidayat, R. ahmad. (2021). Effect of dietary supplementation of probiotic, phytobiotics or their combination on performance, blood indices and jejunal morphology of laying hens during post peak production. Online Journal of Animal and Feed Research, 11(1), 08-12. https://doi.org/10.51227/ojafr.2021.2