Germinación in
vitro de semillas y desarrollo de protocormos de Epidendrum catillus
Rchb. F & Warsz. (Orchideaceae), en diferentes medios de cultivo
In vitro
seed germination and protocorm development of Epidendrum catillus Rchb.
F & Warsz. (Orchideaceae), in different culture media
Javier J. Gonzales-Arteaga1;
Juan Rodríguez-Layza1; Ladislao C. Romero-Rivas1,*;
Adelmo
Párraga-Quintanilla1; Julio A. Olivera-Soto2
1
Laboratorio de Biotecnología Vegetal, Facultad de Ciencias Agropecuarias,
Universidad Nacional Daniel Alcides Carrión, Filial Oxapampa, Carretera Central km 3,5,
Barrio Miraflores, Oxapampa, Perú.
2
Laboratorio de Cultivo in vitro de Tejidos Vegetales, Centro Internacional de
Investigación para la Sustentabilidad (CIIS) Lunahuaná, Universidad Nacional de
Cañete, Lima, Perú.
*
Autor corresponsal: lromero@undac.edu.pe (L. C. Romero-Rivas).
ID
ORCID de los autores
J.
J. Gonzales-Arteaga: https://orcid.org/0000-0001-6196-707X
J. Rodríguez-Layza: https://orcid.org/0009-0008-8521-8629
L.
C. Romero-Rivas: https://orcid.org/0000-0002-6598-3277 A.
Párraga-Quintanilla: https://orcid.org/0000-0001-7392-9599
J.
A. Olivera-Soto: https://orcid.org/0000-0002-3470-1601
RESUMEN
La aplicación de técnicas es importante para
la propagación masiva y eficiente de orquídeas, sin afectar el entorno natural
y su conservación. El objetivo fue establecer un protocolo para la germinación
in vitro de semillas y formación de protocormos de la orquídea E. catillus,
donde se probaron seis medios de cultivo, t1, Knudson; t2, MS 75% + ANA (1,0
mgL-1) + AG3 (3,0 mg L-1); t3, MS 75% + 100 mL L-1
de agua de coco; t4, MS 100% + AG3 (3,0 mg L-1); t5, MS 100% + ANA
(1,0 mg L-1) + AG3 (5,0 mg L-1); t6, MS 100% + 100 mL L-1
de agua de coco. Las semillas fueron obtenidas de una cápsula en estado de
madurez fisiológica, del sector Grapanazú, Huancabamba, provincia de
Oxapampa-Pasco, Perú. Se utilizó el diseño en bloques completos al azar (DBCA).
Se encontró que, a los 64 y 71 dds los tratamientos t1, t3, t4 y t6 igualaron
en la germinación de semillas y desarrollo de protocormos in vitro y todos ellos
fueron superiores a t2 y t5. Se concluye que los medios Knudson, MS al 75 y
100% + 100 mL L-1 de agua de coco y MS 100% + AG3 (3,0 mg L-1),
favorecieron la germinación in vitro.
Palabras
clave:
Protocormo;
germinación in vitro; regulador de crecimiento; agua de coco; orquídea.
ABSTRACT
The application of
techniques is important for the massive and efficient propagation of orchids,
without affecting the natural environment and its conservation. The objective
was to evaluate the effects of six culture media: t1, Knudson; t2, MS 75% + NAA
(1,0 mg L-1) + GA3 (3,0 mg L-1); t3, MS 75% + 100 mL L-1
coconut water; t4, MS 100% + GA3 (3,0 mg L-1); t5, MS 100% + NAA
(1,0 mg L-1) + GA3 (5,0 mg L-1); t6, MS 100% + 100 mL L-1
coconut water on in vitro seed germination and protocorms formation of the
orchid E. catillus. Seeds were obtained from a capsule in stage of
physiological maturity from sector Grapanazú, Huancabamba, province of
Oxapampa-Pasco, Peru. A randomized complete block design was used. It was found
that, at 64 and 71 days, the treatments t1, t3, t4 and t6 had the same seed
germination and development of in vitro protocorms, however, all of them were
higher than t2 y t5. We concluded that Knudson media, MS 75% and 100% + 100 mL L-1
coconut water and MS 100% + GA3 (3,0 mg L-1), enhanced seed
germination.
Keywords: Protocorm; in
vitro germination; plant growth regulator; coconut water; orchid.
Recibido: 27-12-2023.
Aceptado: 12-04-2024.

Las orquídeas pertenecen a una familia de las más
diversas y son muy vulnerables por la destrucción de sus ambientes y extracción (Ávila & Salgado-Garciglia, 2006); en Costa Rica,
en los Cerros La Carpintería, constituye el reservorio de la diver-sidad de
orquídeas, donde el género Epidendrum fue el más diverso, comparado a
otros (Cascante-Marín & Trejos, 2019); asimismo, en Colombia, en un relicto
de bosque alto andino E. caliptratoides fue la más frecuente en seis de
nueve transectos evaluados (Califa & Estupiñan, 2020); en la reserva de
Biosfera de México del Estado de Tamaulipas, se han encontrado 39 especies y 20
géneros de orquídeas (Baltazar & Solano, 2020); en Perú, en bosque de
llanura, Paujil, Oxapampa, se ha regis-trado mayores índices de diversidad en
bosque ribereño (Damian, 2015); por otro lado, E. catillus, se reporta
entre los 860-1500 msnm, monte siempre verde, subxerófilo, de hojas más o menos
dura (Trujillo, 2022).
Por otro lado, las principales actividades que amenazan
el crecimiento y desarrollo natural de las orquídeas son la alteración de su
ecosistema y la extracción de éstas para su comercio ilegal (Martínez-Meléndez et al., 2020). Por la belleza de sus flores, son muy
cotizadas en el mercado; debido a esto, tiene efecto sobre su estado de
conservación en ambientes naturales, como Laelia speciosa, endémica de
Aguas Calientes, México, con protec-ción especial y que está amenazada (González, 2014); asimismo, Hadrolaelia grandis en peligro de
extinción por destrucción de su hábitat y recolección como ornamental, frente a
ello se ha probado varios tipos de medios con miras a la conservación y
propagación (Vudala &
Ribas, 2017); pero existen
otras que se encuentran amenazadas, como es el caso de Telipogon papili
y T. bowmanii (Martel,
2020).
La germinación natural de las semillas de orquí-deas es
alrededor del 5% (Mamani et al., 2022b); presenta dificultades en las primeras
etapas del crecimiento y desarrollo de las plantas (Harris et al., 2021);
donde, dependen de la asociación con un hongo (McKendrick, 2000); se ha
sugerido que existiría una asociación específica entre las especies
intervinientes (Otero & Bayman, 2009). Al respecto, en Dendrobium
officinale, con hongos micorríticos compatibles: Tulasnella sp.
TPYD-2, y Piriformospora indica PI y Tulasnella sp. FDd1
incompatibles, la germinación de semillas fue superior en PI con 67,80%, se
obtuvo plántulas con dos hojas, comparado a TPYD-2, con 37,10%, y en cuanto a
FDd1 no produjo plántulas (Chen et al., 2022); sin embargo, el hongo
micorrítico DYXY033, tiene una alta especificidad con Paphiopedilum hirsutissimum
(Lindl.ex Hook.) Stein, en medio PDA produjo el agrandamiento de la semilla
para dar origen al protocormo (Tian et al., 2023). La germinación asimbiótica
in vitro de diferentes especies de orquídeas, ha permitido introducir y germinar
semillas con una alta tasa de germinación, obtención de plantas sanas y
vigorosas en algunas de ellas (Velázquez et al., 2016); sin embargo, las
respuestas de cada una de éstas en los medios nutritivos es variable (Flores-Hernández
et al., 2017); también, tiene que ver el estado de madurez fisiológica y el
estado inde-hiscente de las cápsulas (Pérez-Martinez & Castañeda-Garzón,
2016).
Los embriones se transforman en estructuras dife-renciadas
denominadas protocormo (Pujasatria et al., 2020), donde sucede la morfogénesis
que a veces demora años (Mendoza, 2016); Eulophia flava (Lindl.)
Hook.f. en MS sin suplementos, es suficiente para germinar semillas en un
26,39%, y formaron plántulas en pos protocormo en 11,50% (Vasupen et al.,
2023). Es importante el contenido de los nutrientes en el medio de cultivo y
del genotipo de la especie; en Cattleya crispa la germinación en MS + 30
g L-1 + 2 g L-1 de Phytagel, produjo la germinación a los
7 ddi, formación de protocormos a los 30 ddi y plantas a los 150 ddi (Vargas et
al., 2023); asimismo, diferentes orquí-deas, resultaron mejores en medio MS +
jugo de piña, variando la germinación entre ocho a doce semanas y con agregado
de plátano se diferen-ciaron órganos axiales a la quinta semana (Chacón-Campana
et al., 2017); también en, Dendrobium cunninghamii, en los medios
Nor-Stog 1973 y Vacin y Went 1949, cada uno + sacarosa al 2%, se obtuvo una
germinación de alrededor del 50% en ambos medios (Diantina et al., 2020); por
otro lado, en Paraphalaenopsis labukensis Shim, A. Lamb & CL Chan,
la mayor tasa de germinación se dio con el medio Knudson C, seguido de MS, con
98,78% y 92,80, respectivamente y Knudson + 0,5 mg L-1 con 17,25%
(Nelson et al., 2023); y en Cremastra appendiculata var. variabilis (Blume)
I.D. Lund. tuvo un mayor porcentaje de germinación, 48,7%, en un medio MS + 30
g L-1 de sacarosa + 8 g L-1 de agar vegetal + 500 mg L-1
de carbón activado, comparado a otros medios (Faisal et al., 2022); También, el
uso de agua de coco al 20% dio una germinación del 86,4% (Mamani et al., 2022a).
asimismo, en medio MS al 50% + 0,3% de carbón activado se ha obtenido la
germinación del híbrido intergenérico Laeliocattleya (Gonçalves et al.,
2016). La orquídea Coelogyne pandurata Lindl. se desarrolló mejor en un
medio a base de fertilizante foliar que contenía emulsión de pescado +
fenolatos y añadido una mezcla de macro y micronutrientes de hidroponía + agar
7 g L-1 + 2 g L-1 de carbón activado, comparado a otros medios (Dwiyani et al., 2022).
Las semillas de cápsulas inmaduras de Prosthechea
fragrans (Sw.) W.E. Higgins, inoculadas en el medio MS modificado con
vitaminas Morel más agua de coco y carbón activado, luego de un mes se
evidenció la aparición de tejidos verdes y por ende la germinación, seguida por
el rápido desarrollo de los protocormos (Salgado & Peñaranda, 2019).
Asimismo, en tres especies de Chloraea (C. crispa, C.
gavilu y C. virescens), C. crispa logró la máxima
germinación cercana al 85%, en medio de cultivo de tomate, seguida del medio
Malmgren Modified (MM) y medio de cultivo de banano con un 70% de germinación;
sin embargo, los embriones de todas las especies en medio MM alcanzaron el
mayor desarrollo, evidenciando brotación distinta en cada una de ellas (Pereira
et al., 2017). Igualmente, el porcentaje de semillas que germinaron en la
especie Anacamptis longicornu fue diferente en los medios Orchimax +
carbón activado y 30 g L-1 y MS con 20 g L-1 en las
diferentes fechas de evaluación entre 60 a 180 dds (Arcidiacono et al., 2021).
Por tanto, la propagación masiva in vitro de diferentes
especies de orquídeas se considera una alternativa biotecnológica efectiva como
medida preventiva para disminuir la presión de la extracción y tráfico ilegal
de las poblaciones silvestres (Castillo-Pérez et al., 2020). Por otro lado,
existen varios medios de germinación in vitro, como Knudson y otros, pero los
requerimiento nutricionales de orquídeas, pueden ser mucho más variados, aún en
las especies del mismo género (Mayo et al., 2010); éstas no se realizan como
otras semillas, sino en simbiosis con hongos micorríticos que les proporcionan
energía para la germinación porque carecen de reservas (Barbery & Morales,
2011); esto hace que, se desarrollen investiga-ciones sobre diferentes medios
en la germinación in vitro de orquídeas. El objetivo de la presente
investigación fue determinar un medio de cultivo para la germinación y
formación de protocormos de E. catillus, colectada en la zona de
Grapanazú, Huancabamba, Oxapampa-Perú.
Ubicación
El trabajo de investigación se ejecutó en el
Laboratorio de Biotecnología Vegetal de La Universidad Nacional Daniel Alcides
Carrión, filial Oxapampa, Carretera Central s/n, km 3,5, Barrio Miraflores,
distrito y provincia Oxapampa, región Pasco, Perú.
Colecta y pretratamiento de material biológico
La colecta de las cápsulas fue en el sector Grapanazú
(18 L; 451097,56E – 8844665,98N UTM) a 2071 msnm (GPS Garmin Monterra),
distrito Huancabamba, provincia de Oxapampa. El monitoreo de la cápsula de E.
catillus, OZ-007-HB, Figura 1a, se realizó hasta observar la madurez
fisiológica; cinco días antes de ser colectada, se aplicó Azoxystrobin +
Difeconazole (1 mL L-1) con un pulverizador manual. Con una tijera
de podar desinfectada con alcohol al 70%, se procedió a extraer la cápsula,
seguido se trasladó al invernadero donde se sumergió durante 10 min en el mismo
fungicida a 0,8 mL L-1, luego en una solución de acaricida
(Etoxazole + Abamectin) 0,15 mL L-1 durante 15 min y envuelta en
papel toalla e introducida en bolsa de polipropileno con su respectivo código
para el ingreso al laboratorio.
En laboratorio
La cápsula se lavó con una solución de jabón líquido
antibacterial (100 mL L-1) por cinco min, seguido se sumergió
durante 15 min en NaOCl al 3% más una gota de Tween 20 por cada 100 mL. En la
cámara de flujo Laminar se realizó un triple enjuague con agua destilada
estéril en agitación, después se sumergió en etanol al 70%, Figura 1b, durante
10 min, finalmente un triple enjuague en agua destilada estéril.
Siembra e incubación de semillas
La cápsula, previamente desinfectada, se cortó con un
bisturí N° 21 sobre una placa de Petri estéril, en secciones longitudinales, Figura
1c; se extrajeron las semillas y se inocularon en los diferentes medios de
cultivo (tratamientos), contenidos en las placas de Petri, dispersándolas en
forma uniforme sobre la superficie, Figura 1d; se rotularon y sellaron con
Parafilm, luego fueron llevadas a la sala de incubación en los anaqueles a 23 °C,
59,57 μmol m-2 s-1 (LP 471 PAR) de luminosidad, 60%
de humedad relativa y fotoperíodo de 16 horas luz (ALION CE AHC 15A).
Figura 1. Cápsula de E. catillus en madurez fisiológica (a), en etanol al
70% (b), en corte longitudinal (c) y dispersión de semillas en medio de cultivo
(d).
Diseño estadístico
El diseño utilizado fue el de bloques completa-mente al
azar, DBCA, (Melo et al., 2020), de seis
tratamientos, Tabla 1, y cinco repeticiones; la unidad experimental estuvo
constituida por una placa de Petri.
Tabla 1
Tratamientos para germinación in vitro de semillas de E.
catillus
|
Trata-miento
|
Descripción / Medio
|
|
t1
|
Formulación Knudson (HIMEDIA, PTO66)
|
|
t2
|
MS
75% + ANA (1,0 mg L-1) + AG3 (3,0 mg L-1)
|
|
t3
|
MS
75% + 100 mL L-1 de agua de coco
|
|
t4
|
MS
100% + AG3 (3,0 mg L-1)
|
|
t5
|
MS 100% + ANA (1,0 mg L-1)
+ AG3 (5,0 mg L-1)
|
|
t6
|
MS 100% + 100 mL L-1 de agua de coco
|
Variables
Las variables, fueron el porcentaje de germinación y de
protocormos; la germinación fue establecida por la presencia de una coloración
verde, y para el estadio de protocormo fue la coloración verde y de aspecto
globoso (Nava, 2010), Figura 2a.
Figura 2. Semillas de E. catillus, en germinación y formación de
protocormos (a) y distribución de cuadriculas para evaluación (b).
Cada placa de Petri se dividió en 4 cuadrantes, y se
marcó una cuadrícula de 4 cm2 solo en dos cua-drantes opuestos,
Figura 2b; con la ayuda de un estereoscopio ACCU-SCOPE a 6,7 aumentos se
registró el total de semillas germinadas y las transformadas en protocormos.
Las evaluaciones fueron realizadas a los 32, 40, 49, 53, 57, 60, 64 y 71 días
después de la siembra (dds).
Análisis estadístico
Los datos de porcentaje fueron transformados en
Arcoseno y procesados con el software estadístico R v4.0.4, mediante análisis
de variancia para encontrar significancia entre los tratamientos y prueba de
comparación múltiple de Duncan (α = 0,05).
El análisis de varianza, ANOVA, Tabla 2,
muestra diferencias altamente significativas para trata-mientos (medios de
cultivo) en porcentaje de germinación y protocormos en las fechas evalua-das,
excepto a los 40 dds; y a los 32 dds en germinación no fueron significativos.
La prueba de comparación múltiple de Duncan, α = 0,05, Figura 3, muestra
que en la germinación de las semillas, a los 32 y 40 dds, en los seis medios de
cultivo, cinco de ellos respondieron de manera similar, el t2 tuvo menor
porcentaje; a los 49, 53 y 57 dds, los tratamientos t1, t3 y t6 fueron
superiores con respecto a los demás; a los 60 dds, el t1 fue superior e igual a
t3; sin embargo, los tratamientos t2 y t5 fueron inferiores a los demás y
calificados como un tercer grupo; a los 64 y 71 dds, los tratamientos t1, t3,
t4 y t6 igualaron en la respuesta y fueron superiores sin diferencias
significativas entre ellos; y t2 y t5 continuaron con menor respuesta en la
germinación de las semillas y sin diferencias significativas entre éstos.
La germinación de las semillas a los 32 y 40
dds, la respuesta fue de manera similar en cinco tratamientos a excepción de
t2, que fue menor, al respecto se observa que, el uso de AG3 en combinación con
ANA en el medio, presentó efecto negativo importante en la germinación in
vitro, porque hubo diferencias entre las semillas germinadas, en comparación
que no contenía esta combinación, esto indicaría que el ANA, estaría bloqueando
la acción del AG3, en el medio de cultivo, en base a que en el t4, que contiene
solamente AG3, la germinación ha progresado igual a los demás medios; es
importante que, en la introducción in vitro la cápsula debe encontrase en
madurez fisiológica y en estado indehiscente; además, han determinado que, en
medio MS reducido al 50% en sus sales con pulpa de banano 60 g L-1,
canela en polvo 1,5 g L-1 y sin o con AIB a 2,5 mg L-1
fueron favorables para la germinación de cuatro especies de orquídeas (Pérez-Martínez & Castañeda-Garzón,
2016); sin embargo, en el presente trabajo, con un 75% (t3) y 100% (t6)
de sales del MS, ambos con 100 mL L-1 de agua de coco, también
favorecieron la germinación; esta etapa es crítica en las orquídeas, debido a
que el embrión carece de reserva o endospermo (Lallana
et al., 2016), que provee de energía para la germinación.
Tabla 2
Anova, coeficiente de variación (CV) y
valores descriptivos en la germinación de E. catillus en seis medios de
cultivo en diferentes fechas de evaluación después de la siembra (dds)
|
Tiempo
(dds)
|
32
|
40
|
49
|
53
|
|
Fuente
de variación
|
gl
|
Germ.
|
Protoc.
|
Germ.
|
Protoc.
|
Germ.
|
Protoc.
|
Germ.
|
Protoc.
|
|
Bloques
|
4
|
0,0022
|
0,0011
|
0,0145
|
0,0145
|
0,0035
|
0,0035
|
0,0036
|
0,0036
|
|
Tratamientos
|
5
|
0,0058
|
0,0159**
|
0,0150
|
0,0150
|
0,0687**
|
0,0732**
|
0,1517**
|
0,1517**
|
|
CV%
|
|
36,97
|
32,93
|
31,60
|
31,60
|
14,49
|
14,42
|
16,35
|
16,35
|
|
Promedio
|
|
0,13
|
0,11
|
0,25
|
0,25
|
0,49
|
0,49
|
0,63
|
0,63
|
|
Mínimo
|
|
0,000
|
0,000
|
0,000
|
0,000
|
0,248
|
0,248
|
0,299
|
0,299
|
|
Máximo
|
|
0,217
|
0,188
|
0,405
|
0,405
|
0,754
|
0,754
|
0,981
|
0,981
|
|
Tiempo
(dds)
|
|
57
|
60
|
64
|
71
|
|
Fuente
de variación
|
gl
|
Germ.
|
Protoc.
|
Germ.
|
Protoc.
|
Germ.
|
Protoc.
|
Germ.
|
Protoc.
|
|
Bloques
|
4
|
0,0031
|
0,0078
|
0,0109
|
0,0109
|
0,0094
|
0,0094
|
0,0195
|
0,0253
|
|
Tratamientos
|
5
|
0,2552**
|
0,2226**
|
0,3429**
|
0,3429**
|
0,3253**
|
0,3253**
|
0,4251**
|
0,4357**
|
|
CV%
|
|
13,59
|
16,57
|
11,50
|
11,50
|
11,88
|
11,88
|
10,64
|
11,12
|
|
Promedio
|
|
0,76
|
0,75
|
0,83
|
0,83
|
0,85
|
0,85
|
0,92
|
0,92
|
|
Mínimo
|
|
0,379
|
0,379
|
0,364
|
0,364
|
0,413
|
0,413
|
0,378
|
0,378
|
|
Máximo
|
|
1,076
|
1,076
|
1,249
|
1,249
|
1,180
|
1,180
|
1,298
|
1,300
|
Nota: Germ. = Germinación, Protoc. =
Protocormo.
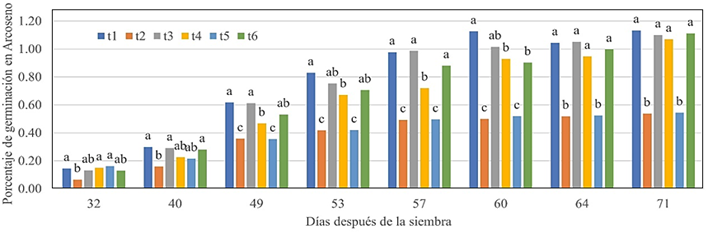
Figura
3.
Germinación de semillas de E. catillus en seis medios de cultivo
evaluados después de la siembra.
Por otro lado, el
inicio de la germinación de la especie en estudio no concuerda con Vanilla
planifolia Jacks. ex Andrews, que tuvo lugar a los 60 días en medio MS +
vitaminas + 30 y 5 g L-1 de sacarosa y carbón activado,
respectivamente (Carranza-Álvarez et al., 2021),
esta diferencia es debido a que se trata de otra especie, y la germinación
depende mucho del medio nutritivo y genotipo (Flores-Hernández
et al., 2017).
Los tratamientos t3 y
t6 que igualaron a t1 (Knudson) considerado como medio específico para la gemina-ción
de varias especies de orquídeas, esto evidencia que es posible la germinación
de E. catillus con MS + agua de coco a la concentración utilizada,
resultados que concuerdan con otros autores, donde reportan que es posible
hacer germinar semillas de orquídeas con el agregado de sustancias orgánicas;
se ha inducido la germinación in vitro de semillas de Rodriguezia longifolia,
Bletia catenulata y Epidendrum spilatum en medio MS suplementado
con jugo de piña variando entre ocho a doce semanas; asimismo, para Epidendrum
secundum, La organogénesis fue mejor con el suplemento de plátano (Chacón-Campana et al., 2017); en Dendrobium
cruentum Rchb. f. en medio VW complementado con homogeneizado de plátano y
papa (1000 mg L-1), germinaron semillas in vitro en un 94,69%, y en
agua de coco (100 mL L-1) ha favorecido en la formación de
protocormos en 47,38% y la combinación de éste con el homoge-neizado de papa
con 52,13% (Samala & Thipwong, 2023); por otro lado, en Anacamptis
longicornu se obtuvo la germinación de 95,5% en medio Orcgimax y 21,4% en
medio MS (Arcidiacono et al., 2021).
En caso de t4, que
contenía MS + AG3, respondió bien a la germinación de la orquídea en estudio,
similar a lo reportado que, a los 30 días de incubación, semillas de Cattleya
mendelii y C. quadricolor en medio MS con 1,5 µM de GA3 y 0,5 µM de
NAA se encontraron la mayor tasa de germinación, 9,2% y 96,4%, respectivamente,
con respecto al medio Knudson 41,7% y 84,3% sin reguladores de crecimiento (Díaz-Álvarez et al., 2015), en caso del medio
Knudson es contrario al resultado del presente trabajo que resultó favorable;
asimismo, en Laelia anceps subsp. Anceps se ha logrado la germinación de
semillas en MS basal adicionado con 1% (p/v) de carbón activado y sin la
adición de reguladores de crecimiento vegetal (Castillo-Pérez
et al., 2020).
Los resultados a 64 y
71 dds, concuerdan en tiempo de germinación con los obtenidos de semillas de
cápsulas de tamaño intermedio de 9 a 10 cm de longitud, que germinaron
alrededor del 90% a los dos meses de cultivo en medio MS sin carbón activado y
mantenidas en total oscuridad; pero, las semillas cultivadas igualmente en la
oscuridad, en medio con carbón activado no germinaron (Flores
et al., 2017). Por otro lado, en medio MS reducido al 50% en sus sales
con pulpa de banano 60 g L-1, canela en polvo 1,5 g L-1 y
sin o con AIB a 2,5 mg L-1 fueron favorables para la germinación de
cuatro especies de orquídeas; sin embargo, estos medios no lograron romper la
latencia de embriones inmaduros de las cápsulas (Pérez-Martinez &
Castañeda-Garzón, 2016). Las especies de orquídeas responden de diferente
manera a un medio de germinación in vitro, Dactylorhiza majalis mejoró
en cierta manera cuando la concentración de nitrato fue de 1 mg L-1 (Figura et al., 2020).
La prueba de
comparación múltiple de Duncan, α = 0,05, Figura 4, muestra que a los 32 y
40 dds, la formación de protocormos en los seis medios de cultivo, cinco de
ellos respondieron de manera similar, sin diferencias estadísticas entre ellos
y el t2 tuvo menor porcentaje; mientras que, a los 49, 53 y 57 dds, t1, t3 y t6
fueron superiores con respecto a los demás tratamientos.
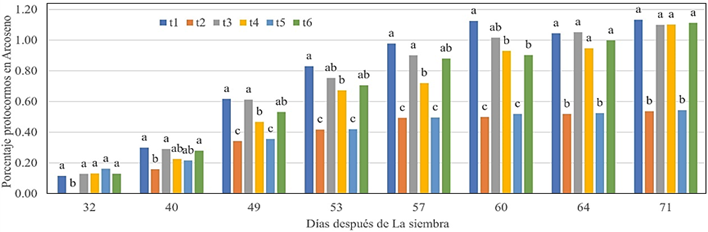
Figura
4.
Formación de protocormos de E. catillus en diferentes medios de cultivo
evaluados después de la siembra.
Asimismo, t2 igualó estadísticamente a t5 y
fueron de menor porcentaje comparado al resto de tratamientos; a los 60 dds, el
t1 fue superior e igual a t3; sin embargo, los tratamientos t2 y t5 fueron
inferiores a los demás y calificados como un tercer grupo; a los 64 y 71 dds,
tuvieron igual compor-tamiento, los tratamientos t1, t3, t4 y t6, sin
diferencias significativas entre ellos y superiores a t2 y t5 los que tuvieron
una menor respuesta en la formación de protocormos, sin diferencias signifi-cativas
entre éstos.
La formación de protocormos, a los 32 y 40
dds, concuerda con los resultados que, en Prosthechea fragrans (Sw.) W.
E. Higgins en el medio MS + vitaminas Morel, agua de coco y carbón activado que
luego de un mes originó tejidos verdes y rápido desarrollo de protocormos
(Salgado y Peñaranda, 2019); mientras que, la combinación de BAP 1,5 mg L-1
+ ANA 0,15 mg L-1, resultó mejor con un pro-medio de 6,75 brotes, y
observaron la órgano-génesis de Prosthechea citrina (La Llave &
Lex.), en el rango de BAP 1,0 a 3,0 mg L-1 (Cazarez
et al., 2016). En Trichopilia tortilis Lindl. se observa la
formación de protocormos a los 45 días en medio MS líquido y sólido; sin
embargo, a los 120 días en el medio sólido se encontró mayor germinación,
91,64% con respecto al medio líquido 78,94% (Mendoza,
2016); por otro lado, en Serapias vomeracea germinó 58,77% en
medio Knudson, superior a los medios Vacin and Went y Lindemann y a sus
diluciones al 50% incluido a Knudson (Acemi & Özen, 2019).
El desarrollo de protocormos, en E.
catillus de 49 a 60 dds, muestra una variación en los seis medios de
cultivo, donde se observa tres grupos; t2 y t5 fueron los tratamientos de
menor repuesta, resultados que concuerdan con lo reportado para Hadrolaelia
grandis, donde encontraron una variación entre los medios dentro de cada
periodo de evaluación (Vudala
& Ribas, 2017); en Cattleya aurantiaca, Encyclia
adenocaula, Epidendrum radicans, Euchile citrina, Laelia
albida, L. autumnalis, Oncidium cavendishianum, y O.
tigrinum la adición de reguladores como auxinas, citoquininas y giberelinas
al medio MS, favorece el crecimiento a partir de protocormos provenientes de
semillas (ÁviLa &
SaLgado-GarcigLia, 2006). Por otro lado, el desarrollo en Laelia
rubescens Lindl. fue mejor en medio, Phytamax + jugo de piña comparado a
Phytamax + agua de coco, ambos a una dosis de 100 mL L-1 (Mayo-Mosqueda et al., 2020).
De los seis medios de
cultivo utilizados para la germinación y formación de protocormos de E.
catillus, cuatro de ellos a partir de los 64 dds, resultaron ser superiores
frente a t2 y t5, estos fueron la formulación Knudson (t1), los que tuvieron MS
en un 75% (t3) y 100% (t6) ambos con 100 mL L-1 de agua de coco y MS
100% + 3,0 mg L-1 de AG3 (t4), respectivamente. En base a los
resultados, se recomienda probar otras combina-ciones de MS con agua de coco.
Los
autores agradecen a la Dirección del Instituto Central de Investigación –
Vicerrectorado de Investigación - de la Universidad Nacional Daniel Alcides
Carrión (UNDAC), Pasco-Perú, por el financiamiento del proyecto “Desarrollo de
protocolos en la propagación in vitro de Orquídeas y cultivos de importancia
económica para la provincia de Oxapampa”, a través del cual se realizó el
presente trabajo como parte de sus objetivos. También expresan su agradecimiento
a Ing. Marilyn C. Enciso Waller; Bach. Odalyz L. Zúñiga Salcedo e Ing Mayra Y.
Monago Curi por el soporte técnico brindado.
Al
Servicio Nacional Forestal y de Fauna Silvestre (SERFOR), por la autorización
concedida mediante resoluciones RDG N° D000428-2020-MIDAGRI-SERFOR-DGGSPFFS y
RD N° D000044-2022-MIDAGRI-SERFOR-DGGSPFFS-DGSPF para realizar la presente
investigación.
REFERENCIAS
BIBLIOGRÁFICAS
Acemi, A., & Özen, F. (2019). Optimization of in vitro
asymbiotic seed germination protocol for Serapias vomeracea. The EuroBiotech
Journal,
3(3), 143–151. https://doi.org/10.2478/ebtj-2019-0017
Arcidiacono, M., Catalano, C., Motisi, A., Sajeva, M., Carimi,
F., & Carra, A. (2021). Influence of culture conditions on in vitro
asymbiotic germination of anacamptis longicornu and ophrys panormitana
(Orchidaceae). Plants, 10, 2–12. https://doi.org/10.3390/plants10112543
Ávila, I., & Salgado-Garciglia, R. (2006). Propagación y
mantenimiento in vitro de orquídeas mexicanas, para colaborar en su
conservación. Biologicas, 8, 138–149.
Baltazar, S., & Solano, R. (2020). Diversidad y rasgos
funcionales de orquídeas terrestres en bosques de un área natural protegida del
noreste de México. Botanical Sciences, 98(4), 468–485.
https://doi.org/10.17129/botsci.2600
Barbery, R., & Morales, I. (2011). Manual para el cultivo
in vitro de la orquidea Cattleya nobilior “Flor símbolo de Concepción.” In Centro
para la Participación y el Desarrollo Humano Sostenible CEPAD – Bolivia. El
Pais.
Califa, S. D., & Estupiñan, L. H. (2020). Patrones de
distribucióbn de orquídeas en un relicto de bosque altoandino,
Cundinamarca-Colombia. Colombia Forestal, 23(1), 5–19.
https://doi.org/10.14483/2256201X.14816
Carranza-Álvarez, C., Trinidad-García, K., Reyes-Hernández,
H., Castillo-Pérez, L., & Fortanelli-Martínez, J. (2021). Efecto de
extractos orgánicos naturales sobre la micropropagación de Jacks. ex Andrews
(Orchidaceae). Biotecnia, 23(1), 5–12.
Cascante-Marín, A., & Trejos, C. (2019). Diversidad y
vulnerabilidad de la flora orquideológica de un bosque montano nuboso del valle
central de Costa Rica. Lankesteriana, 19(1), 31–55. https://doi.org/10.15517/lank.v19i1.37031
Castillo-Pérez, L. J., Maldonado-Miranda, J. J.,
Alonso-Castro, Á. J., & Carranza-Álvarez, C. (2020). Efecto de
6-bencilaminopurina y nitrato de potasio sobre la micropropagación in vitro de
Laelia anceps subsp. anceps (Orchidaceae). Biotecnia, 22(1),
32–38. https://doi.org/10.18633/biotecnia.v22i1.1122
Cazarez, T. L., Graciano, J. de J., Solís, S., Díaz, B.,
Nájera, J. A., & Montoya, J. B. (2016). Propagación in vitro de la orquídea
Prosthechea citrina (La Llave & Lex.) W. E. Higgins nativa del estado de
Durango, México. Investigación y Ciencia de La Universidad Autónoma de
Aguascalientes, 67, 19–25. https://doi.org/10.33064/iycuaa2016672269
Chacón-Campana, M. A., Ponce-Aranibar, L. M., Muñiz-Luna, S.
B., Huaracha-Quispe, D. P., & Flores-Huisa, K. (2017). Propagación in-vitro
de cuatro especies de orquídeas nativas de la región Cusco. Cantua, 16, 26–43.
https://doi.org/10.51343/cantu.v16i0.630
Chen, X. G., Wu, Y. H., Li, N. Q., & Gao, J. Y. (2022). What role does
the seed coat play during symbiotic seed germination in orchids: an
experimental approach with Dendrobium officinale. BMC Plant Biology, 22(1),
1–11. https://doi.org/10.1186/s12870-022-03760-0
Damian, A. (2015). Distribución vertical y horizontal de la
familia Orchidaceae en tres tipos de bosques en el sector Paujil, al interior
del Parque Nacional Yanachaga Chemillen (Pasco-Perú). Q’EUÑA, 6,
67–76.
Diantina, S., Kartikaningrum, S., McCormick, A. C., Millner,
J., McGill, C., Pritchard, H. W., & Nadarajan, J. (2020). Comparative in
vitro seed germination and seedling development in tropical and temperate
epiphytic and temperate terrestrial orchids. Plant Cell, Tissue and Organ
Culture, 143(3), 619–633. https://doi.org/10.1007/s11240-020-01947-7
Díaz-Alvarez, E., Torres-Galiano, C., Rojas-Cortés, Á., &
De La Barrera, E. (2015). Germinación y desarrollo in vitro de dos orquídeas
amenazadas endémicas de Colombia, Cattleya mendelii y Cattleya quadricolor. Gayana. Botánica, 72(2),
213–220. https://doi.org/10.4067/s0717-66432015000200005
Dwiyani, R., Fitriani, Y., & Mercuriani, I. S. (2022). The Alternative
Media Supporting the Protocorm and Plantlet Growth of the Indonesian Black
Orchid (Coelogyne pandurata Lindl.) Grown In Vitro. Caraka Tani: Journal of
Sustainable Agriculture, 37(1), 152–160.
https://doi.org/10.20961/carakatani.v37i1.55956
Faisal, M., Seob, P. K., Kang, K. W., & Sivanesan, I.
(2022). In Vitro Propagation of Cremastra appendiculata var. variabilis by
Asymbiotic Seed Germination. Horticulturae, 8(926), 2–11.
https://doi.org/10.3390/horticulturae8100926
Figura, T., Weiser, M., & Ponert, J. (2020). Orchid seed
sensitivity to nitrate reflects habitat preferences and soil nitrate content. Plant
Biology, 22(1), 21–29. https://doi.org/10.1111/plb.13044
Flores, O., Cuéllar, J., Montes, M., Gámez, M., Gónzales, M.,
Guevara, M., & Aguilar, N. (2017). Germinación in vitro de semillas de
Vanilla planifolia Jacks y comparación de métodos de
micropropagación. Avances En Investigacion Agropecuaria, 21(2),
69–83.
Flores-Hernández, L. A., Robledo-Paz, A., & Jimarez-Montiel,
M. J. (2017). Medio de cultivo y sustitutos del agar en el crecimiento in vitro
de orquídeas. Rev. Mex. Cienc. Agríc, 8(6), 1315–1328.
Gonçalves, L. de M., Machado, M. de F. P. S., Ballesta, P.,
Mora, F., Milaneze, M. A., & Mangolin, C. A. (2016). Suplementos orgánicos
para el cultivo in vitro del híbrido Laeliocattleya (Orchidaceae). Idesia,
34(1), 47–54. https://doi.org/10.4067/S0718-34292016000100006
González, L. de A. (2014). Propagación in vitro de Laelia
speciosa (Orchidaceae) nativa de Aguascalientes [Univeresidad Autónoma de
Aguascalientes].
Harris, C., Landero, I., Alvarado, J. F., & Hernández, R.
(2021). Germinación
de orquídeas utilizando un método sencillo y económico, reproducible en
ambientes no óptimos. Revista Mexicana de Ciencias Agrícolas, 12(5),
915–919. https://doi.org/10.29312/remexca.v12i5.2555
Lallana, V., Billard, C., Martinez, V., García, L., Barsanti,
M., Di Persia, J., Dalzotto, C., Scimpft, K., & De la Cruz, V. (2016).
Conservación de orquídeas nativas de Entre Ríos utilizando técnicas de cultivo
de tejidos “in vitro.” Ciencia, Docencia y Tecnología Suplemento, 6(6),
94–121.
Mamani, B., Muriel, A., Maquera, A., & Nova, M. (2022a).
Germinación in vitro de Epidendrum secundum con diferentes agentes
gelificantes y concentraciones de agua de coco. ACTA NOVA, 10(3), 345–359.
Mamani, B., Nova, M., & Espinal, J.
A. (2022b). Germinación in vitro de Zigopetalum maculatum con
diferentes protocolos de desinfección y adición de agua de coco en el medio de
cultivo. Revista de Investigación e Innovación Agropecuaria y de Recursos
Naturales, 9(2), 26–36. https://doi.org/10.53287/szsf1344ls18k
Martel, C. (2020). Análisis de la categorización del estado de
conservación de las orquídeas en el Perú: el caso del género Telipogon. Revista
Peruana de Biologia, 27(2), 267–270.
https://doi.org/10.15381/rpb.v27i2.16886
Martínez-Meléndez, N., Martínez-Meléndez, M., Hernán-dez-Rodríguez,
J. P., & Jiménez López, D. A. (2020). Orquídeas silvestres: amenazas y
acciones locales para su conservación en el Parque Nacional de Lagos de
Montebello y su zona de influencia, Chiapas, México. Centro de Investigación
Científica de Yucatán, A.C., 12, 238–245.
Mayo, A., Cázares, J., de la Cruz, E., & Flores, A.
(2010). Germinación in vitro de semillas y desarrollo de plántulas de orquídeas
silvestres de Tabasco. In Colección José N. Rovirosa, Biodiversidad,
Desarrollo Sustentable y Trópico Húmedo. Universidad Juárez Autónoma de
Tabasco.
Mayo-Mosqueda, A., Maceda-López, L. F., Andrade-Canto, S. B.,
Noguera-Savelli, E., Caamal-Velázquez, H., Cano-Sosa, J. del S., &
Alatorre-Cobos, F. (2020). Efficient protocol for in vitro propagation of Laelia
rubescens Lindl. from asymbiotic seed germination. South African Journal
of Botany, 133, 264–272. https://doi.org/10.1016/j.sajb.2020.07.030
McKendrick, S. (2000). Manual para la germinación in vitro de
orquídeas. In
Ceiba Foundation for Tropical Conservation.
Melo, O., López, L., & Melo, S. (2020). Diseño de
Experimentos. Métodos y Aplicaciones (2da. ed.). Universidad Nacional de
Colombia.
Mendoza, I. E. (2016). Eficiencia de los medios nutritivos
basales: sólido y líquido en la etapa de establecimiento in vitro de la
orquídea “Tripita” Trichopilia tortilis Lindl. Producción
Agropecuaria y Desarrollo Sostenible, 5, 43–57. https://doi.org/10.5377/payds.v5i0.5429
Nava, J. J. (2010). Propagación in vitro y establecimiento
en invernadero de las orquídeas Trichocentrum carthagenense (Jacq.) Sw y Laelia
eyermaniana Rchb. f., para su conservación y potencial aprovechamiento sustentable
[Instituto Politécnico Nacional Secretaría de Investigación y Posgrado].
Nelson, H. V., Gansau, J. A., Mus, A. A., Mohammad, N. N.,
Shamsudin, N. A., Amin, J., & Rusdi, N. A. (2023). Developing Paraphalaenopsis
labukensis (Shim, A. Lamb & C.L. Chan), an Orchid Endemic to Sabah,
Borneo, Asymbiotic Seed Germination and In Vitro Seedling Development. Horticulturae, 9(6),
1–19. https://doi.org/10.3390/horticulturae9060681
Otero, J., & Bayman, P. (2009). Germinación simbiótica y
asimbiótica en semillas de orquídeas epifitas. Acta Agronómica, 58(4),
270–276.
Pereira, G., Albornoz, V., Romero, C., Lara, S.,
Sánchez-Olate, M., Rios, D., & Atala, C. (2017). Germinación asimbiótica en
tres especies de Chloraea (Orchidaceae) de Chile. Gayana. Botánica, 74(1),
131–139. https://doi.org/10.4067/s0717-66432017005000107
Pérez-Martinez, B. A., & Castañeda-Garzón, S. L. (2016).
Propagación in vitro de orquídeas nativas como una contribución para la
conservación ex situ. Biotecnología Vegetal, 16(3), 143–151.
Pujasatria, G. C., Miura, C., & Kaminaka, H. (2020). In
vitro symbiotic germination: A revitalized heuristic approach for orchid
species conservation. In Plants (Vol. 9, Issue 12, pp. 1–15). MDPI AG.
https://doi.org/10.3390/plants9121742
Salgado, J. M., & Peñaranda, L. V. (2019). Modificaciones en
medios de cultivo aplicadas en conservación y producción in-vitro de orquídeas.
Revista Colombiana de Investigaciones Agroindustriales, 6(1),
17–28. https://doi.org/10.23850/24220582.1815
Samala, S., & Thipwong, J. (2023). Influences of
Organic Additives on Asymbiotic Seed Germination of Dendrobium cruentum Rchb.
f. for In Vitro Micropropagation. Trends in Sciences, 20(3),
1–11. https://doi.org/10.48048/tis.2023.4181
Tian, F., Wang, J. C., Bai, X. X., Yang, Y. B., Huang, L.,
& Liao, X. F. (2023). Symbiotic seed germination and seedling growth of
mycorrhizal fungi in Paphiopedilum hirsutissimun (Lindl.Ex Hook.) Stein
from China. Plant Signaling and Behavior, 18(1), 1–16.
https://doi.org/10.1080/15592324.2023.2293405
Trujillo, D. (2022). Las orquídeas en el mundo vegetal de los
Andes peruanos: Una revisión y actualización toxonómica. Revista Peruana de
Biologia, 29(3), 1–44. https://doi.org/10.15381/rpb.v29i3.22929
Vargas, B., Corredor-Prado, J. P., Pescador, R.,
Montoya-Serrano, F. S., Vesco, L. L. D., & Suzuki, R. M. (2023).
Morpho-anatomy of in vitro germination and cryopreservation of the orchid
Cattleya crispa (Orchidaceae). Revista de Biologia Tropical, 71(1),
1–13. https://doi.org/10.15517/REV.BIOL.TROP..V71I1.52338
Vasupen, E., Bundithya, W., & Potapohn, N. (2023). Effects
of Coconut Water, Benzylaminopurine, and Naphthalene Acetic Acid on Seed
Germination and Rhizome Food Reserve: In Vitro Culture of Eulophia flava
(Lindl.) Hook.f. Current Applied Science and Technology, 23(3),
1–12. https://doi.org/10.55003/cast.2022.03.23.006
Velázquez, V., Quijano-Avila, J., & Rodríguez-Avila, N.
(2016). Análisis de diferentes sustratos en la germinación y multiplicación in
vitro de orquídeas silvestres del estado de Campeche. Revista Del Centro de
Graduados e Investigación, 31(63), 27–31.
Vudala, S. M., & Ribas, L. L. F. (2017). Seed storage and
asymbiotic germination of Hadrolaelia grandis (Orchidaceae). South African Journal
of Botany, 108, 1–7. https://doi.org/10.1016/j.sajb.2016.09.008