 |
INTRODUCCION
Zooplancton en áreas de cultivo de Argopecten purpuratus “concha de abanico” en Piura, Perú
Zooplankton Argopecten purpuratus “fan shell” culture areas in Piura, Perú
Gean Paul Rufino Chiroque1 *; Ronald Wilmer Marcial Ramos2
1 Escuela Profesional de Ciencias Biológicas, Facultad de Ciencias, Universidad Nacional de Piura. Urb. Miraflores S/N, Castilla, Piura, Perú.
* Autor corresponsal: rufinochiroque@gmail.com (G. P. Rufino Chiroque).
ORCID de los autores:
G. P. Rufino Chiroque: https://orcid.org/0009-0002-8129-3388 R. W. Marcial Ramos: https://orcid.org/0000-0002-3836-1894
RESUMEN
Se determinaron las especies de zooplancton presentes en áreas de cultivo de Argopecten purpuratus “concha de abanico” Vichayo, Sechura, Piura; se relacionaron los parámetros físicos y químicos con la composición del zooplancton; la unidad muestral fue de 100 ml de agua, en la que se evaluó zooplancton, temperatura, pH, oxígeno y salinidad, fueron colectadas 180 muestras en 5 puntos de muestreo elegidos al azar, muestreos por arrastre y vertical durante seis meses; determinándose las especies con el uso de claves taxonómicas y oxímetro, peachímetro y refractómetro para evaluar factores físicos y químicos. Los datos obtenidos fueron analizados mediante estadística descriptiva e inferencial, con decisiones de 95% de confianza. Los resultados indican que en el zooplancton predomina el phyllum Arthropoda y dentro de él, la clase Copepoda; los valores físicos y químicos se hallaron dentro de los rangos establecidos. Concluyéndose que del 100% de las especies de zooplancton presentes en las áreas evaluadas, el 69,84% pertenecen al phylum Arthropoda; y que, la comunidad de zooplancton se mantiene en equilibrio dinámico debido a una baja dominancia y valores elevados de riqueza de especies, diversidad y equitabilidad.
Palabras clave: Bahía; Copépodos; abundancia relativa; parámetros.
ABSTRACT
The zooplankton species present in Argopecten purpuratus “fan shell” culture areas were determined in Vichayo, Sechura, Piura; The physical and chemical parameters were related to the composition of the zooplankton; The sampling unit was 100 ml of water, in which zooplankton, temperature, pH, oxygen and salinity were evaluated. 180 samples were collected from 5 sampling points, chosen at random, using drag and vertical sampling, for six months. ; species are determined using taxonomic keys and the appropriate equipment to evaluate physical and chemical factors. The data obtained were analyzed using descriptive and inferential statistics, with decisions of 95% confidence. The results indicate that the phyllum Arthropoda predominates in the zooplankton and within it, the Copepoda class; The physical and chemical values were within the established ranges. Concluding that of 100% of individuals of the zooplankton species community present in the evaluated areas, 69.84% of them belong to the Phylum Arthropoda; and that the zooplankton community remains in dynamic equilibrium due to low dominance and high values of species richness, diversity and equitability.
Keywords: Bay; Copepods; relative abundance; parameters.
Recibido: 29-01-2024.
Aceptado: 20-04-202.
El zooplancton desempeña un papel esencial en los ecosistemas marinos como vínculo entre los productores primarios (fitoplancton) y los niveles tróficos superiores en las redes alimentarias, y al formar un grupo dinámico de reclutas para múltiples especies de invertebrados y peces (Brierley, 2017; Peijnenburg & Goetze, 2013; Richardson, 2008).
El zooplancton es un componente importante de cualquier entorno acuático porque forma la base de las cadenas y las redes alimentarias. El nexo intermediario para los flujos de energía desde los productores primarios, como el fitoplancton y los microorganismos, hasta los niveles de consumo de la cadena alimentaria es el zooplancton (Al et al., 2018; Howick, 1984). Proporcionan una indicación esencial de la condición trófica de la producción secundaria en los ecosistemas acuáticos (Arruda et al., 2017; Vicente et al., 2012).
La producción secundaria en los ecosistemas acuáticos depende directa o indirectamente del zooplancton. También desempeñan un papel importante en el reciclaje de nutrientes y el ciclo de energía dentro de sus respectivos entornos. El zooplancton es el principal modo de transferencia de energía entre el fitoplancton y los peces (Howick, 1984). Casi todos los peces dependen del zooplancton para su sustento durante sus etapas larvarias, y algunos peces comen zooplancton durante toda su vida. El plancton se ha utilizado para monitorear los ecosistemas acuáticos y la calidad del agua como bioindicador (Vicente et al., 2012).
El zooplancton tiene una alta diversidad y abundancia taxonómica y se distribuye de manera desigual en los océanos, con dispersión y agregación impulsadas por una combinación de procesos físicos e interacciones biológicas en diferentes escalas espaciales (Folt & Burns, 1999; McManus & Woodson, 2012; Pinel-Alloul, 1995).
La velocidad y dirección del flujo, y los gradientes en temperatura, salinidad y densidad del agua contribuyen a los patrones de distribución del zooplancton (Ockhuis et al., 2017; Pinti et al., 2019; Wells et al., 2021). La aparición y distribución del zooplancton depende de varios factores, como el cambio climático, tipos de hábitat, propiedades fisicoquímicas y factores bióticos (Ahmad et al., 2011; Alexander, 2012; Richardson, 2012; Cottenie et al., 2001).
Los factores ambientales desempeñan un papel importante en la regulación de la distribución del zooplancton; por ejemplo, la temperatura del agua afecta crecimiento, desarrollo y mortalidad de los organismos. Las diferentes especies muestran diversas tolerancias al aumento o disminución de los rangos de temperatura, y se eliminan los individuos particularmente sensibles (Andrule-wicz et al., 2008; Tunowski, 2009).
El pH bajo promueve una disminución de la abundancia del zooplancton, una disminución de la biodiversidad y la extinción de algunas especies, mientras que las condiciones alcalinas asociadas con una alta producción primaria promueven el desarrollo y la abundancia del zooplancton (Bednarz et al., 2002; Mustapha, 2009; Bai et al., 2022; Griboff et al., 2018; Hoang et al., 2021).
La disponibilidad de luz determina la distribución del productor, lo que impacta indirectamente en la diversidad y distribución de los animales. El oxígeno disuelto en el agua, necesario para la supervivencia de todos los organismos acuáticos, es otro factor abiótico importante. Las deficiencias de oxígeno pueden influir directamente en la mortalidad del organismo y tiende a reducir la diversidad de la comunidad y la riqueza de las especies acuáticas bajo presión antropogénica (Hoang et al., 2021; Sathicq & Gómez, 2018).
La disponibilidad de nutrientes, como nitratos y fosfatos, tiene un impacto significativo en la estructura y abundancia del zooplancton en un ambiente acuático. Una ligera modificación dentro de las propiedades físico-químicas afecta la diversidad del ecosistema. No obstante, cualquier cambio en estos parámetros puede afectar el crecimiento, el desarrollo y la madurez de los peces (Nikolski & Birkett, 1963; Jhingran, 1985).
La variabilidad climática y las presiones antropo-génicas impactan la estructura y la dinámica de los ecosistemas pelágicos, el plancton puede ser un buen indicador de dichos cambios ambientales (Bedford et al., 2018; Pitois et al., 2021). Los datos de series temporales existentes sugieren que los cambios hidroclimáticos inducen modificaciones latitudinales en la estructura de la comunidad de copépodos (Beaugrand et al., 2002). El estado de los hábitats pelágicos se evalúa utilizando indicadores de plancton para comprender los procesos ecológicos y los impactos del clima y los cambios antropogénicos (Bedford et al., 2018).
A pesar de la importancia del zooplancton en el ecosistema marino, existen pocos estudios sobre la composición específica, distribución y la relación que este grupo pueda tener con las variables oceanográficas (temperatura, oxígeno, etc.), más cuando se presentan lluvias moderadas, pudiendo haber cambios en la comunidad. El presente estudio tuvo como objetivo determinar las especies de zooplancton que habitan en la zona de Vichayo, Sechura, Perú, junto a ello registrar y relacionar las variables oceanográficas con las especies zooplanctónicas.
MATERIAL Y METODOS
La investigación se realizó en la Bahía de Sechura (5° 12´ - 5° 50´S y 81° 12´ - 81° 51´W), ubicada en la provincia de Sechura, en la zona occidental de la región Piura, al norte del Perú. Se seleccionaron 5 puntos de muestreo, los cuales se muestran en la Tabla 1 y Figura 1.
Tabla 1
Puntos de muestreo en la zona de vichayo, Sechura, Piura, Perú
|
Puntos de muestreo |
Coordenadas georreferenciadas con WGS |
|
PUNTO - A |
5° 48´ 32.266´´ - 80° 58´ 6.985´´ |
|
PUNTO - B |
5° 48´32.266´´- 80° 57´37.903´´ |
|
PUNTO - C |
5°48´46.829´´- 80° 57´37.903´´ |
|
PUNTO - D |
5°48´46.829´´- 80° 58´ 6.985´´ |
|
PUNTO - E |
5º 48’ 40.892’’ – 80º 57’ 52.019’’ |
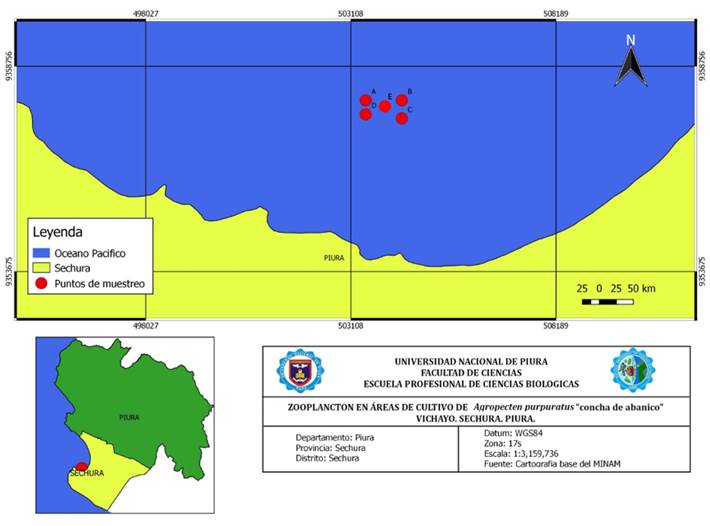
Figura.1. Ubicación geográfica de los puntos de muestreo A, B, C, D, E zona Vichayo, en la bahía de Sechura, Piura, Perú.
Las muestras fueron colectadas mensualmente de julio a diciembre 2019 por método superficial o arrastre y el vertical. Por cada punto se obtuvieron 3 frascos por cada tipo de muestreo. El muestreo superficial se realizó con una embarcación de madera con motor fuera de borda con la ayuda de una red de 75 micras, se realizaron arrastres de 5 a 10 min en cada uno de los 5 puntos de muestreo, generalmente en horas de la mañana. Para los muestreos verticales se utilizó una manguera 20 metros de longitud, una vez estando en el lugar de muestreo se procedió a bajar la manguera tratando de mantener la verticalidad de ésta, como la zona de muestreo tiene 15 m aproximadamente de profundidad, la manguera llegó hasta ese límite, cuando llegó a esa profundidad, se cerró la llave superior para poder así no botar el contenido de la maguera (Lindahl, 1986). Luego ya la manguera en cubierta se trasvaso el contenido en un balde para luego ser filtrado con la red de 75 micras. El registro de datos de las variables oceanográficas fue tomado in situ, para el oxígeno disuelto (mg/L) y la temperatura (°C), se utilizó un Oxímetro (EZODO PDO 480); para el control de pH se usó un medidor de pH impermeable (Hanna, sensibilidad 0,01), y para determinar la salinidad (%o) se utilizó un refractómetro (THE01501) (Precisión ± 1 %o). Ya con las muestras en el laboratorio se realizó el conteo de las especies y para las especies más abundantes se fraccionaron las muestras una, dos o más veces utilizando el método de los beakers Huntsman Marine Laboratory. Para el análisis cualitativo y cuantitativo se empleó un este-reoscopio (Motic SMZ-161) y un microscopio (LEICA DM500) se determinó hasta el nivel taxonómico más bajo posible. Para la deter-minación de las especies de zooplancton se utilizó: Atlas de Zooplancton del Atlántico Sudoccidental y métodos de trabajo con el Zooplancton Marino (Boltovskoy, 1981), Catálogo de Zooplancton en el Mar Peruano área Pisco, San Juan (Santander et al.,1981), y trabajos de Albornoz & Wehrtmann (1997), Aravena & Palma (2002), Alvariño (1969), Bowman & Gruner (1973), Cruz (1983), Cruz (1996), Fenaux (1968), Grice (1963), Kasturiragan (1963), Medellín et al. (2009), Núñez et al. (1992), Rozbaczylo & Moreno (2003), Rusell (1981) y Vidal (1968).
RESULTADOS Y DISCUSION
Se determinaron 34 especies las cuales estuvieron distribuidas en 25 familias (Tabla 2). La frecuencia porcentual de las especies según Phylum en las muestras extraídas por arrastre fueron: Arthropoda (56%), Chordata (17%), Foraminífera y Annelida (7%), Cnidaria (10%) y Bryozoa (3%) (Figura 2).
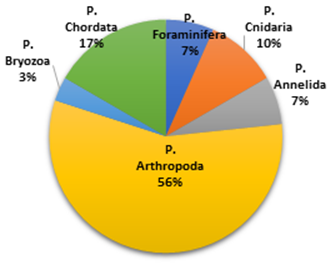
Figura 2. Distribución porcentual de especies por Phyllum de zooplancton en muestras extraídas por arrastre.
En la Figura 3 se observa que la frecuencia por-centual de las especies según Phylum determi-nados en las muestras extraídas mediante el muestreo vertical, fueron: Arthropoda (63%), Chordata (17%), Foraminífera y Cnidaria (7%), Annelida y Bryozoa (3%). En las figuras 4 y 5 se muestran las especies encontradas en el cultivo de Argopecten purpuratus.
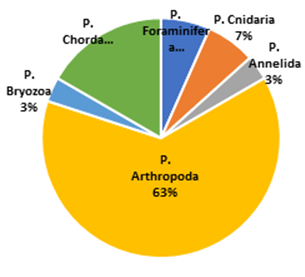
Figura 3. Distribución Porcentual de especies por Phyllum de zooplancton en muestras extraídas por muestreo vertical.
Tabla 2
Zooplancton presente en áreas de cultivo de Argopecten purpuratus “concha de abanico”
|
ORDEN |
FAMILIA |
ESPECIE |
|
Rotaliida |
Bolivinitidae |
Bolivina bicostata |
|
Bolivina pacifica |
||
|
Nonioninae |
Nonionella sp. |
|
|
Siphonophorae |
Diphyidae |
Muggiaea atlantica |
|
Anthoathecata |
Corynidae |
Sarsia sp. |
|
Narcomedusae |
Solmundaeginidae |
Solmundella bitentaculata |
|
Spionida |
Spionidae |
Polydora sp. |
|
Magelonida |
Magelonidae |
Magelona phyllisae |
|
Onychopoda |
Podonidae |
Pleopis polyphemoides |
|
Calanoida |
Acartiidae |
Acartia tonsa |
|
Calanidae |
Calanus chilensis |
|
|
Centropagidae |
Centropages brachiatus |
|
|
Paracalanidae |
Paracalanus parvus |
|
|
Lucicutiidae |
Lucicutia flavicornis |
|
|
Cyclopoida |
Oithonidae |
Oithona sp. |
|
Oithona setigera |
||
|
Oithona nana |
||
|
Clausidiidae |
Hemicyclops sp. |
|
|
Oncaeidae |
Oncaea venusta |
|
|
Oncaea media |
||
|
Corycaeidae |
Corycaeus dubbius |
|
|
Corycaeus sp. |
||
|
Harpacticoida |
Tachidiidae |
Euterpina acutifrons |
|
Ectinosomatidae |
Microsetella rosea |
|
|
Microsetella norvergica |
||
|
Siphonostomatoida |
Pontoeciellidae |
Pontoeciella abyssicola |
|
Euphausiacea |
Euphausiidae |
Euphausia sp. |
|
Decapoda |
Pinnotheridae |
Pinnixa sp |
|
Cheilostomatida |
Membraniporidae |
Membranipora sp |
|
Copelata |
Oikopleuridae |
Oikopleura longicauda |
|
Oikopleura dioica |
||
|
Oikopleura sp. |
||
|
Clupeiformes |
Engraulidae |
Engraulis ringens |
|
Anchoa nausus |

Figura 4. Vista de las especies encontradas en el cultivo de Argopecten purpuratus “concha de abanico”, zona Vichayo. I Pinnixa sp. (Zoea I) II Euphausia sp. (Furcilia) III Microsetella norvegica IV Euterpina acutifrons V Oithona sp. VI Oithona nana VII Hemicyclops sp VIII Corycaeus sp IX Paracalanus parvus (Copepodito).
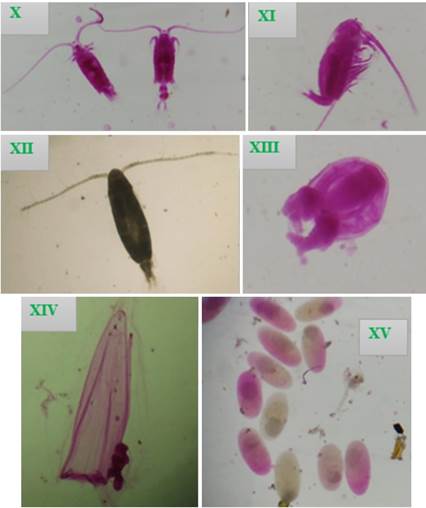
Figura 5. Vista de las especies encontradas en el cultivo de Argopecten purpuratus “concha de abanico”, zona Vichayo. X Izq. macho, Der. hembra Centropages brachiatus XI Calanus chilensis XII Acartia tonsa (hembra adulta) XIII Sarsia sp. XIV Muggiaea atlantica (Nectoforo superior) XV Engraulis ringens (Huevos en diferentes estadios).
En las tablas 3 y 4 se presentan los parámetros fisicoquímicos y el total de muestras por método de arrastre y vertical. Las medias de los parámetros fisicoquímicos del total de las muestras por arrastre, mostrando que la mayor temperatura fue en agosto con 23,3 °C y la menor en septiembre con 16,4 °C. El pH varió entre 7,9 y 7,2 con media de 7,6. Por otro lado, el oxígeno su valor más alto fue en octubre con 6,4 y el más bajo en julio con 4,7. Se observa también que las especies van disminu-yendo con el pasar de los meses llegando a diciembre con 2 especies del phylum Artrópoda. La Tabla 4 de igual manera presenta las medias de los parámetros fisicoquímicos del total de las muestras por el método vertical, mostrando que la mayor temperatura se dio en noviembre con 20,1 °C y la menor en agosto con 13,3 °C; el oxígeno varió entre 6,6 (agosto) y 4,8 (julio). De igual manera el número de individuos van disminuyendo con el pasar de los meses, llegando a diciembre con 11 especímenes del phylum Arthropoda.
Durante los seis meses de muestreo (julio a diciembre – 2019) se registraron un total de 34 especies de zooplancton que suman 16080 especímenes; además, en todos los muestreos (temporal y espacial), el phyllum Arthropoda predominó sobre los demás en riqueza de especies y abundancia relativa; la mayoría de las especies (85%) pertenecen a la clase Maxillopoda. Así mismo, el 69,8% de abundancia relativa corresponde al phyllum Arthropoda, seguido de Chordata con 29,5%; representando los Phyllum restantes el 0,64%, como se puede observar en la Tabla 5.
Tabla 3
Parámetros fisicoquímicos y especies en el total de muestras (arrastre) cultivo de Argopecten purpuratus “concha de abanico”
|
MES |
Julio |
Agosto |
Setiembre |
Octubre |
Noviembre |
Diciembre |
Media |
|
Temperatura |
18,8 |
23,3 |
16,4 |
16,7 |
21,4 |
21,3 |
19,7 |
|
pH |
7,7 |
7,4 |
7,9 |
7,9 |
7,4 |
7,2 |
7,6 |
|
Oxígeno |
4,7 |
6,1 |
5,5 |
6,4 |
5,8 |
5,7 |
5,7 |
|
Salinidad |
34,6 |
34,8 |
33,6 |
33,6 |
35 |
34,8 |
34,4 |
|
Phylum |
Julio |
Agosto |
Setiembre |
Octubre |
Noviembre |
Diciembre |
Especies |
|
Foraminífera |
2 |
1 |
1 |
0 |
0 |
0 |
2 |
|
Cnidaria |
3 |
0 |
0 |
0 |
0 |
0 |
3 |
|
Annelida |
2 |
1 |
0 |
0 |
0 |
0 |
2 |
|
Arthropoda |
15 |
9 |
9 |
9 |
3 |
2 |
17 |
|
Bryozoa |
1 |
1 |
1 |
0 |
0 |
0 |
1 |
|
Chordata |
2 |
2 |
0 |
3 |
0 |
0 |
5 |
|
Total |
25 |
14 |
11 |
12 |
3 |
2 |
30 |
Tabla 4
Parámetros fisicoquímicos y especímenes en total de muestras (vertical) cultivo de Argopecten purpuratus “concha de abanico”
|
MES |
Julio |
Agosto |
Setiembre |
Octubre |
Noviembre |
Diciembre |
Media |
|
Temperatura |
17,5 |
13,3 |
13,8 |
16,4 |
20,1 |
16,2 |
16,2 |
|
pH |
7,8 |
7,7 |
7,9 |
7,9 |
7,5 |
7,8 |
7,8 |
|
Oxígeno |
4,8 |
6,6 |
5,8 |
6,5 |
6,1 |
6,0 |
6,0 |
|
Salinidad |
34,6 |
35 |
33,6 |
33,8 |
35 |
34,4 |
34,4 |
|
PHYLUM |
Julio |
Agosto |
Setiembre |
Octubre |
Noviembre |
Diciembre |
Individuos |
|
Foraminífera |
22 |
0 |
6 |
0 |
0 |
0 |
28 |
|
Cnidaria |
11 |
0 |
0 |
0 |
0 |
0 |
11 |
|
Annelida |
14 |
0 |
0 |
0 |
0 |
0 |
14 |
|
Arthropoda |
4 037 |
5 536 |
235 |
115 |
673 |
11 |
10 607 |
|
Bryozoa |
0 |
7 |
3 |
0 |
0 |
0 |
10 |
|
Chordata |
865 |
182 |
1 |
2 359 |
0 |
0 |
3 407 |
|
Total |
4 949 |
5 725 |
245 |
2 474 |
673 |
11 |
14 077 |
Tabla 5
Riqueza de especies y abundancia relativa (individuos) por phyllum de zooplancton para muestreos por arrastre, vertical y total en áreas de cultivo de Argopecten purpuratus “concha de abanico”
|
PHYLUM |
MÉTODO DE MUESTREO |
TOTAL |
|||||
|
Arrastre |
Vertical |
||||||
|
Especie |
Individuos |
Especie |
Individuos |
Especie |
Individuos |
||
|
Foraminifera |
Fi |
2 |
12 |
2 |
28 |
3 |
40 |
|
% |
6,67 |
0,60 |
6,67 |
0,20 |
8,82 |
0,25 |
|
|
Cnidaria |
Fi |
3 |
12 |
2 |
11 |
3 |
23 |
|
% |
10,00 |
0,60 |
6,67 |
0,08 |
8,82 |
0,14 |
|
|
Annelida |
Fi |
2 |
10 |
1 |
14 |
2 |
24 |
|
% |
6,67 |
0,50 |
3,33 |
0,10 |
5,88 |
0,15 |
|
|
Arthropoda |
Fi |
17 |
624 |
19 |
10607 |
20 |
11231 |
|
% |
56,67 |
31,15 |
63,33 |
75,35 |
58,82 |
69,84 |
|
|
Bryozoa |
Fi |
1 |
5 |
1 |
10 |
1 |
15 |
|
% |
3,33 |
0,25 |
3,33 |
0,07 |
2,94 |
0,09 |
|
|
Chordata |
Fi |
5 |
1340 |
5 |
3407 |
5 |
4747 |
|
% |
16,67 |
66,90 |
16,67 |
24,20 |
14,71 |
29,52 |
|
|
TOTAL |
Fi |
30 |
2003 |
30 |
14077 |
34 |
16080 |
|
% |
100 |
100 |
100 |
100 |
100 |
100 |
|
En la Tabla 5 se observa que, en el muestreo por arrastre, el Phyllum Arthropoda predomina en riqueza de especies (56,67%); y el Phyllum Chordata en abundancia relativa (66,90%); mientras que, en el muestreo vertical y en el total de muestras, el predominio en riqueza y abundancia relativa de especies le corresponde al Phyllum Arthropoda.
Tales resultados, sobre la composición del zooplancton, coinciden con lo reportado por diversos autores en diferentes lugares del litoral peruano (Aronés, 2022; Bances & Ramírez, 2016; Barturen, 2015; Pinedo, 2014). Estos valores, así como los registrados en este trabajo, lógicamente, no son iguales, debido a una serie de variables físicas, químicas y biológicas, que modifican la composición del zooplancton en riqueza y abundancia relativa; pero, existe absoluta concordancia entre todos, que en el zooplancton marino predomina el Phyllum Arthropoda; y, dentro de él, la clase Maxillopoda.
Aronés (2022) evaluó la variabilidad temporal del zooplancton en playa Carpayo (Callao) desde enero 2014 hasta octubre 2019, encontrando 69 especies reunidas en 30 grupos; siendo los predominantes copépodos (96%) y cirrípedos (83%). Entre las especies predominantes de copépodos se reportó Acartia sp. (83%), Paracalanus parvus (63%) y Hemicyclops sp. (56%).
Por otro lado, del total de copépodos registrados en este trabajo, predominan Oithona sp (31,9%), y Paracalanus parvus (18,6%); y una especie del phylum Chordata Engraulis ringens (22,9%) encontrándose una especie en común con lo reportado por Aronés (2022), donde predominan Acartia sp. (83%), Paracalanus parvus (63%) y Hemicyclops sp. (56%); mientras que Barturen (2015) registró en el litoral de Lambayeque 74 especies, predominando Paracalanus parvus (69%) y Acartia tonsa (68%); y, Pinedo (2014) al evaluar el zooplancton de la costa peruana encontró 40 especies, correspondiendo 89,5% a copépodos.
Oithona sp. fue el copépodo más abundante en todos los meses de muestreo, si bien es cierto no coincide con algunos otros reportes de estudios de zooplancton, según Palomares (1996) el género que tuvo un aporte importante en la abundancia en sus muestreos fue Oithona, incrementando su abundancia en diciembre y fue el único del orden Cyclopoida, ellos justifican la presencia de esta especie con el florecimiento de fitoplancton que hubo en diciembre, mencionan que este género es de afinidad oceánica y tiene mayor preferencia por nanofitoplancton que por microfitoplancton.
Esto explicaría la abundancia de Oithona sp. ya que el lugar de muestreo es área de cultivo de Argopecten purpuratus, “concha de abanico”, zona con buenas condiciones oceanográficas, con presencia de afloramientos, que propician una gran productividad primaria y parámetros físicoquí-micos óptimos durante el periodo de evaluación.
Otra especie que se presentó en mayor porcentaje fue Engraulis ringens “anchoveta”, la cual es de importancia económica y se presentó en casi todos los meses de muestreo, mayormente se encontró en fase de huevo.
La abundancia de Engraulis ringens “anchoveta” en el Perú se debe sin duda a la combinación de una serie de factores biológicos, ambientales, climatológicos, entre los cuales tiene una gran incidencia el evento El Niño (López, 2015).
Por otro lado, la distribución, abundancia espacial y temporal del zooplancton, están influenciadas por las variaciones verticales y horizontales de los factores fisicoquímicos, que dependen, principal-mente, del desplazamiento de las masas de agua de la Corriente Costera Peruana (CCP); la cual genera fenómenos de afloramiento, productividad, etc.; cuyos efectos se manifiestan en los factores físico – químicos; especialmente, en la parte superficial del agua; toda vez que entre ella y el espacio, se realiza, en ambos sentidos, un flujo constante de energía radiante (Zuta & Guillén, 1970), tal como lo sostienen otros autores (Bances & Ramírez, 2016; Barturen, 2015).
En general, la temperatura superficial del agua durante el desarrollo de la fase de campo y en el periodo establecido vario en promedio entre 15,1 °C para setiembre y 20,8 °C en noviembre, con una media general de 18,3 °C. Cabe resaltar que, en todos los puntos de muestreo por arrastre, el valor máximo de temperatura registrado correspondió a agosto con un promedio de 23,8 °C.
Esta aparente contradicción es explicable, debido a que la temperatura superficial del agua está influenciada por la radiación solar y la actividad antrópica; de allí que, el agua de la zona evaluada al no ser muy profunda; puede aumentar frente a una intensa radiación solar (Zuta & Guillén, 1970), esto ocurrió en Agosto; de allí que, esta variable se presentó elevada y en todos los puntos de muestreo por arrastre en agosto.
Nuestros resultados revelaron relaciones significa-tivas entre los factores ambientales y las pobla-ciones de Oithona sp., así como una zona de reproducción de Engraulis ringens, la presencia de huevos en varios estadios corrobora esto, la otra especie abundante es el copépodo Paracalanus parvus, especies todas importantes en la trama trófica marina. Comportándose todas ellas como las especies que explotan adecuadamente las condiciones de la zona de cultivo de concha de abanico en la Bahía de Sechura.
CONCLUSIONES
El zooplancton en Vichayo estuvo compuesto por 34 especies, siendo el Phylum predominante Arthropoda con 63%. La especie que más predomino fue Oithona sp (31,9%), seguido de Engraulis ringens (22,9%) y Paracalanus parvus (18,6%). La mayor abundancia relativa corres-pondió al phyllum Arthropoda con el 69,84%; seguido del phyllum Chordata con un 29,52%; y con el 0,64 % todos los demás phyllum.
REFERENCIAS BIBLIOGRAFICAS
Ahmad, U., Parveen, S., Khan, A., Kabir, H., Mola, H., & Ganai, A. (2011). Zooplankton population in relation to physico-chemical factors of a sewage fed pond of Aligarh (UP), India. Biol. Medicine., 3, 336–341.
Al, M. A., Alam, D., Akhtar, A., Xu, H., Islam, S., Kamal, A. H. M., Uddin, M. M., & Alam, W. (2018). Annual pattern of zooplankton communities and their environmental response in a subtropical maritime channel system in the northern Bay of Bengal, Bangladesh. Acta Oceanol. Sinica, 37, 65–73.
Alexander, R. J. (2012). Interactions of Zoo Plankton and Phytoplankton with Cyanobacteria. Master's thesis, University of Nebraska – Lincoln, NE, EE. UU.
Albornoz, L., & Wehrtmann, L. (1997). Descripción y clave de los primeros estadios larvales de camarones carídeos (Decapada: Hippolytidae, Alpheidae, Rhynchocinetidae) de aguas costeras de Chile. lnvest. Mar., Valparaíso, 25, 121-133.
Alvariño, A. (1969). Los Quetognatos del Atlántico, distribución y notas esenciales de sistemática. Instituto Español de Oceanografía. Subsecretaría de la Marina Mercante, 4, 1-27.
Andrulewicz, E., Szymelfenig, M., Urbanański, J., Węsławski, J., & Węsławski, S. (2008). Mar Báltico: vale la pena conocerlo. Notab. Academia Verde., 7, 1–113.
Aravena, G., & Palma, S. (2002). Taxonomic identification of appendicularians collected in the epipelagic waters off northern Chile (Tunicata, Appendicularia). Revista Chilena de Historia Natural, 75, 307 - 325.
Aronés, K. (2022). Variabilidad temporal del zooplancton en la Estación Fija frente a Carpayo, Callao entre 2014 y 2019. Bol Inst Mar Perú, XXXVII (1), 77- 90.
Arruda, G. D. A., Diniz, L. P., Almeida, V. L. D. S., Neumann, S., & de Melo, M. (2017). Estructura de la comunidad de rotíferos en sistemas de piscicultura asociados a un embalse semiárido neotropical en el noreste de Brasil. Aquac. Res., 48, 4910–4922.
Bai, X., Jiang, Y., Jiang, Z., Zhu, L., & Feng, J. (2022). Nutrient potentiate the responses of plankton community structure and metabolites to cadmium: A microcosm study. Journal of Hazardous Materials, 430, 128506.
Beaugrand, G., Reid, P. C., Ibáñez, F., Lindley, J. A., & Edwards, M. (2002). Reorganization of North Atlantic Marine Copepod Biodiversity and Climate. Science, 296, 1692-1693.
Bances, S., & Ramírez, P. (2016). Evaluación Ambiental en la zona marino costera de Lambayeque - Perú. Mayo - junio 2016. Lima: IMARPE. Perú.
Barturén, J. (2015). Variación en la composición, distribución y abundancia del zooplancton marino superficial frente al litoral de Lambayeque y su relación con las condiciones oceanográficas durante los años 2006 y 2007. Chiclayo: Universidad Nacional Pedro Ruiz Gallo.
Bedford, J., Johns D., Greenstreet, S., & McQuatters, A. (2018). Plankton as prevailing conditions: A surveillance role for plankton indicators within the Marine Strategy Framework Directive. Marine Policy, 89, 109-115.
Bednarz, T., Starzecka, A., & Mazuriewicz, G. (2002). Procesy mikrobiologiczne towarzyszace glonowym i sinicowym zakwitom wody. Wiadomości Bot., 46, 45–55.
Boltovskoy, D. (1981). Atlas del zooplancton del Atlántico Sudoccidental y métodos de trabajo con el zooplancton marino. Mar de Plata: Publicación Especial del INIDEP.
Bowman, T., & Gruner, H. (1973). The families and genera of hyperiidea (crustacea: amphipoda). Editado por Smit Hosonian. Washington.
Brierley, A. S. (2017). Plancton. Biología actual, 27, 478-483.
Cottenie, K., Nuytten, N., Michels, E., & De Meester, L. (2001). Zooplankton community structure and environmental conditions in a set of interconnected ponds. Hydrobiologia, 442, 339–350.
Cruz, M. (1983). Pterópodos y Heterópodos del golfo de Guayaquil. Acta Oceanográfica del Pacífico. INOCAR, Ecuador, 2(2), 569-587.
Cruz, M. (1996). Pterópodos Tecostomados y Heterópodos (Gasterópodos} como bioindicadores del evento "El Niño" 1992, en la estacion fija "La Libertad", Ecuador. Acta Oceanográfica del Pacífico. INOCAR, Ecuador, 8(1), 51-66.
Falkenhaug, T., Tande, K. S., & Semenova, T. (1997). Diel, variaciones estacionales y ontogenéticas en las distribu-ciones verticales de cuatro copépodos marinos. Serie Progreso de la Ecología Marina, 149, 105–119.
Fenaux, R. (1968). Algunas apendicularias de la costa Peruana. Bol. lnst. Mar Perú, 1(9), 536–552.
Folt, C., & Burns, C. (1999). Biological Drivers of Zooplankton Patchiness. Trends in Ecology & Evolution, 14, 300–305.
Gliwicz, MZ. (1986). Predation and evolution of vertical migration in zooplankton. Nature, 320, 746–748.
Griboff, J., Horaček, M., Wunderlin, D. A., & Monferran, M. V. (2018). Bioaccumulation and trophic transfer of metals, As and Se through a freshwater food web affected by antrophic pollution in Córdoba, Argentina. Ecotoxicology and Environmental Safety, 148, 275–284.
Hays, G. C. (2003). A review of the adaptive significance and ecosystem consequences of zooplankton diel vertical migrations. Hydrobiologia, 503, 163 – 170.
Hoang, T. C., Brausch, J. M., Cichra, M. F., Philips, E. J., Van Genderen, E., & Rand, G. M. (2021). Effects of Zinc in an Outdoor Freshwater Microcosm System. Environmental Toxicology and Chemistry, 40, 2051–2070.
Howick, G. L. (1984). Zooplankton and benthic macroinverte-brates in lake carl blackwell. Proc. Okla Acad. Ciencia., 64, 63–65.
Jhingran, V. G. (1985). Fish and Fisheries of India, Hindustan Publishing Corporation: Delhi, India.
Grice, G. (1963). A review of the genus Candacia (copepoda: Calanoida) with an annotated list of the species and a key for their identification. Zooplogische Mededelingen, 10, 1-24.
Kasturiragan, L. (1963). A key for the identification of the more common planktonic copepoda of lndian coastal waters. Editado por N. K. Panikkar, Council of Scientific and Industrial Research. New Delhi: Publication N° 2.
Lindahl, O. (1986). A dividable hose for phytoplankton sampling. In Report of the Working Group on Phytoplankton and Management of their affects, international Council for the Exploration of the Sea C.M 1986/L26. Annex3. 3.
López, D. (2015) El régimen de ordenamiento pesquero de la anchoveta (Engraulis ringens) en el Perú y su impacto en la sostenibilidad del recurso. Universidad de Piura.
Medellín, J., Campos, N., Franco, A., & Jaimes, J. (2009). Taxonomía de larvas zoea de crustáceos decápodos del área nororiental del mar Caribe Colombiano. Bol. lnvest. Mar. Cost., 38(2), 55-73.
Mustapha, M. K. (2009). Conjunto de zooplancton del embalse de Oyun, Offa, Nigeria. Rev. Biol. tropo., 57, 1027–1047.
McManus, M. A., & Woodson, C. B. (2012). Plankton distribution and ocean dispersal. J Exp Biol, 215, 1008–1016.
McQuatters, A., Edwards, M., Helaouët, P, Johns, D, Nicholas, J., Owens, P, Dionysios, E. Raitsos, Schroeder, D, Skinner, J, & Stern, R. (2015). The Continuous Plankton Recorder survey: How can long-term phytoplankton datasets contribute to the assessment of Good Environmental Status?, Estuarine, Coastal and Shelf Science, 162, 88-97.
Nikolsky, G. V., & Birkett, L. (1963). The ecology of fishes. Londres, Reino Unido, Volumen 352.
Núñez, J., Hemández, F., Ocaña, O., & Jiménez, S. (1992). Poliquetos Pelágicos de Canarias: Familias Jospilidae y Lopadorrhyn-chidae. Vieraea, 21, 101-108.
Ockhuis, S., Huggett, J., Gouws, G., & Sparks, C. (2017). The ‘suitcase hypothesis’: Can entrainment of meroplankton by eddies provide a pathway for gene flow between Madagascar and KwaZulu-Natal, South Africa? African Journal of Marine Science, 39, 435–451.
Palomares, J. (1996). Estructura espacial y variación estacional de los copépodos en la Ensenada de La Paz. Oceánides, 11(1), 29-43.
Peijnenburg, K. T. C. A., & Goetze, E. (2013). High evolutionary potential of marine zooplankton. Ecology & Evolution, 3, 2765–2781.
Pinel-Alloul, P. (1995). Spatial heterogeneity as a multiscale characteristic of zooplankton community. Hydrobiologia, 300, 17–42.
Pinti, J., Kiorboe, T., Thygensen, U. H., & Visser, A. W. (2019). Trophic interactions drive the emergence of diel vertical migration patterns: A game-theoretic model of copepod communities. Proceedings of the Royal Society B, 286, 20191645.
Pitois, S., Graves, C., Close, H., Lynam, C., Scott, J., Tilbury, J., van der Kooij, J., & Culverhouse, P. (2021). A first approach to build and test the Copepod Mean Size and Total Abundance (CMSTA) ecological indicator using in-situ size measurements from the Plankton Imager (PI). Ecological Indicators, 123, 107307.
Pinedo, L. (2014). Estructura comunitaria del zooplancton de la costa peruana asociado a las masas de agua durante los veranos del 2000 y 2003. Lima: Universidad Nacional Mayor de San Marcos.
Rozbaczylo, N., & Moreno, R. (2003). Poliquetos holoplanctónicos del pacífico suroriental frente a Chile e islas oceánicas. Guías de identificación y biodiversidad de la fauna Chilena. Apuntes de zoología, Universidad Arturo Prat, lquique, Chile.32 pp.
Richardson, A. J. (2008). In hot water: zooplankton and climate change. ICES Journal of Marine Science, 65, 279–295.
Rusell, F. (1981). Narcomedusae, Familias: Aeginidae, Solmaridae, Cuninidae. En: Numerical and Taxonomic lndex of ICES Plankton ldentification Leaflets, 1939- 2001. editado por J. Lindley. England, UK: lnternational Council for the exploration of the sea. Fich. ldent. Zooplancton 166. 5 pp.
Santander, H., Luyo, R., Carrasco, S., Véliz, M., & De Castillo, O. (1981). Catálogo de zooplancton en el Mar Peruano. Lima: IMARPE.
Sathicq, M. B., & Gómez, N. (2018). Effects of hexavalent chromium on phytoplankton and bacterioplankton of the Río de la Plata estuary: an ex-situ assay. Environmental Monitoring and Assessment, 190, Art. 229.
Tunowski, J. (2009). Zooplankton structure in heated lakes with differing thermal regimes and water retention. Arch. Pol. Fish, 17, 291–303.
Vidal, J. (1968). Copepodos calanoideos epipelágicos de la expedicion Marchile 11. Gayana Instituto Central de Biología. Vol. 15.
Vicente, K., Mwebaza, L., Makanga, B., & Nachuha, S. (2012). Variations in zooplankton community structure and water quality conditions in three habitat types in northern Lake Victoria. Lakes & Reservoirs, 17, 83–95.
Wells, S. R., Bresnan, E., Cook, K., Eerkes, D., Machairopoulou, M., Mayor, D. J., Rabe, B., & Wright, P. J. (2021). Environmental drivers of a decline in a coastal zooplankton community. ICES Journal of Marine Science, 78, 844–854.
Zuta, S., & Guillén, O. (1970). Oceanografía de las aguas costeras del Perú. Imarpe - Boletín, 2(5), 161-323.