 |
INTRODUCCIÓN
The development of cover legumes by arbuscular mycorrhizal fungi depends on the degree of specificity of the symbionts
Luz Elizabeth Valdiviezo-Saavedra; Winston Franz Ríos-Ruiz*; José Carlos Rojas García;
Diana Trace Sandoval-Flores
Laboratorio de Microbiología Agrícola "Raúl Ríos Reátegui", Departamento Académico Agrosilvopastoril, Facultad de Ciencias Agrarias, Universidad Nacional de San Martín, Jr. Maynas 177, Tarapoto, San Martín, Perú.
* Autor corresponsal: wrios@unsm.edu.pe (W. F. Ríos-Ruiz).
ID ORCID de los autores:
L. E. Valdiviezo-Saavedra: https://orcid.org/0009-0000-1329-8510 W. F. Ríos-Ruiz: https://orcid.org/0000-0002-6513-3379
J. C. Rojas-García: https://orcid.org/0000-0002-6513-3379 D. T. Sandoval-Flores: https://orcid.org/0009-0003-8780-7244
RESUMEN
Los hongos micorrízicos arbusculares se asocian a las leguminosas para mejorar la fijación de nitrógeno y la absorción de nutrientes, promoviendo así el crecimiento vegetal y reduciendo el uso de fertilizantes. Este estudio buscó medir el grado de especificidad y dependencia de leguminosas de cobertura inoculadas con hongos micorrízicos arbusculares provenientes de suelos degradados, con pH ácido y baja fertilidad del sector de Alto Cumbaza, San Martín, Perú. Se evaluaron cuatro especies (Cajanus cajan, Canavalia ensiformis, Crotalaria juncea y Vigna unguiculata) con tres tipos de hongos (Acaulospora rugosa, Acaulospora sp. y Ambispora appendicula) en un diseño completamente aleatorizado con tres repeticiones. Canavalia ensiformis inoculada con Acaulospora rugosa alcanzó mayor altura (271,67 cm), mientras que Crotalaria juncea con Acaulospora sp. mostró mayor biomasa aérea (27,52 g). Vigna unguiculata con Acaulospora rugosa presentó alta colonización (71,48%) y dependencia micorrízica (54,40%), y Cajanus cajan con Ambispora appendicula mostró alto contenido de fósforo (5,01%). Estas interacciones variaron significativamente, evidenciando la especificidad y dependencia de las asociaciones. Estos hallazgos son importantes para el establecimiento de programas de recuperación de suelos degradados con leguminosas de cobertura inoculadas con hongos micorrízicos arbusculares.
Palabras clave: Hongo micorrízico arbuscular; leguminosas de cobertura; compatibilidad funcional;
dependencia micorrízica.
ABSTRACT
Arbuscular mycorrhizal fungi associate with legumes to enhance nitrogen fixation and nutrient absorption, thus promoting plant growth and reducing fertilizer usage. This study aimed to measure the degree of specificity and dependency of cover legumes inoculated with arbuscular mycorrhizal fungi from degraded soils with acidic pH and low fertility in the Alto Cumbaza sector, San Martín, Peru. Four species (Cajanus cajan, Canavalia ensiformis, Crotalaria juncea, and Vigna unguiculata) were evaluated with three types of fungi (Acaulospora rugosa, Acaulospora sp., and Ambispora appendicula) in a completely randomized design with three replications. Canavalia ensiformis inoculated with Acaulospora rugosa reached greater height (271.67 cm), while Crotalaria juncea with Acaulospora sp. showed higher aboveground biomass (27.52 g). Vigna unguiculata with Acaulospora rugosa exhibited high colonization (71.48%) and mycorrhizal dependency (54.40%), and Cajanus cajan with Ambispora appendicula showed high phosphorus content (5.01%). These interactions varied significantly, demonstrating the specificity and dependency of the associations. These findings are important for establishing programs to recover degraded soils with cover legumes inoculated with arbuscular mycorrhizal fungi.
Keywords Arbuscular mycorrhizal fungus; cover legumes; functional compatibility; mycorrhizal dependency.
Recibido: 30-03-2024.
Aceptado: 24-06-2024.
Los hongos micorrízicos arbusculares (HMA) representan microorganismos del suelo que establecen relaciones simbióticas con aproxima-damente el 80%-90% de las especies de plantas vasculares y el 90% de las plantas agrícolas, incluidos numerosos cultivos de importancia económica como leguminosas, cereales y hortalizas (Diagne et al., 2020). En la actualidad, existe un creciente interés por comprender la diversidad funcional de los HMA y su compatibilidad con diversas plantas de interés agrícola, con el propósito de determinar la especificidad y dependencia de la asociación, así como los beneficios que cada especie de HMA puede ofrecer a los cultivos (Brito et al., 2021). Aprovechando el potencial de los HMA, los agricultores pueden construir sistemas agrícolas más sostenibles que aborden los desafíos de la seguridad alimentaria, la degradación ambiental y el cambio climático (Herath, et al., 2024).
La recuperación de áreas degradadas es un desafío significativo en la agricultura contemporánea. En este sentido, el uso de leguminosas de cobertura emerge como una estrategia prometedora, ya que estas plantas no solo incrementan la fertilidad del suelo mediante la fijación simbiótica de nitrógeno atmosférico, sino que también contribuyen a mitigar la erosión, mejorar la estructura del suelo, estabilizar las variaciones de temperatura y controlar las malezas (Jena et al., 2022). Asimismo, las leguminosas exhiben una alta capacidad de micorrización, debido a su habilidad para colonizar las raíces y aumentar la población de esporas en el suelo (Ríos-Ruiz et al., 2019), participando en la regulación del crecimiento y la mejora de la productividad en diferentes ecosistemas y bajo condiciones de estrés abiótico y biótico (Wahab et al., 2023). Sin embargo, es importante tener en cuenta que las distintas especies de leguminosas muestran respuestas variables a la micorrización, y no todos los HMA inducen la misma respuesta en la planta (Chippano et al., 2022), lo que subraya la necesidad de comprender la compatibilidad funcional y dependencia originada por el grado de interacción entre la planta y el hongo (Davison et al., 2020) y que a su vez, favorezcan la adquisición de nutrientes minerales en condiciones de deficiencia de nutrientes en las plantas lo cual podría ayudar a mejorar los procesos agrícolas sostenibles (Miyata & Umehara, 2024).
A nivel global, el incremento descontrolado de suelos degradados representa un desafío para la agricultura, dado su bajo contenido de nutrientes, reducida actividad biológica y pérdida de materia orgánica (Kopittke et al., 2019). En este contexto, los microorganismos del suelo, como los HMA, desempeñan un importante papel en la recuperación de estos suelos al actuar como inoculantes microbianos que mejoran la nutrición, productividad y adaptación de las plantas a condiciones ambientales adversas, a la par que ejercen control sobre patógenos (Salomon et al., 2022; Islam et al., 2024).
Es importante comprender estas relaciones para proponer la producción de inoculantes de HMA efectivos y adaptados a diversos entornos, lo que permitiría aumentar la productividad de manera sostenible, por lo que el objetivo de este estudio fue evaluar el grado de especificidad y dependencia de especies de leguminosas de cobertura y HMA seleccionados de suelos degradados.
METODOLOGÍA
Descripción del Experimento
El experimento fue diseñado para investigar el efecto de diferentes especies de leguminosas de cobertura y HMA en varias variables de creci-miento y nutricionales de las plantas. Se realizó en condiciones de invernadero utilizando macetas que contenían una mezcla de arena y suelo agrícola como sustrato. Se empleó un diseño comple-tamente aleatorizado con un arreglo factorial de 4x4, considerando cuatro especies de leguminosas de cobertura (Cajanus cajan, Canavalia ensiformis, Crotalaria juncea y Vigna unguiculata), tres especies de HMA (Acaulospora rugosa, Acaulospora sp. y Ambispora appendicula) y un testigo sin inocular, lo que resultó en un total de 16 tratamientos con tres repeticiones por tratamiento, totalizando 48 unidades experimentales. Las variables evaluadas fueron: altura de la planta, número de hojas, biomasa seca de la parte aérea, porcentaje de colonización micorrízica, número de esporas y contenido de fósforo foliar. Los HMA utilizados fueron proporcionados por el banco de cepas de HMA del laboratorio de Microbiología Agrícola "Raúl Ríos Reátegui" de la Universidad Nacional de San Martín (UNSM), los cuales fueron aislados de suelos degradados con pH ácido y baja fertilidad del sector de Alto Cumbaza, San Martín, Perú (Ríos-Ruiz et al., 2019). La Figura 1 muestra imágenes de las esporas de los HMA utilizados en el estudio.
|
|
|
|
|||
|
Acaulospora rugosa |
Acaulospora sp. |
Ambispora appendicula |
Figura 1. Esporas de hongos micorrízicos arbusculares utilizadas en el presente estudio. Adaptado de Ríos-Ruiz et al. (2019).
Preparación del sustrato
El sustrato utilizado en el experimento se compuso de una combinación de arena de río y suelo agrícola. Previamente la arena recolectada fue lavada con agua abundante, secada a temperatura ambiente y esterilizada en autoclave (Astell, AMA 440070, Kent, Reino Unido) a 121°C durante una hora. Este procedimiento se repitió tres veces para asegurar la completa eliminación de microor-ganismos presentes. Una vez esterilizada la arena, se mezcló con suelo agrícola, clase franco limo arcillo, colectado en el sector “Cumbacillo”, Tarapoto, Perú, en una proporción de 2 partes de arena por 1 parte de suelo. La mezcla resultante se distribuyó uniformemente en las macetas, las cuales fueron previamente descontaminadas con detergente y lavadas con agua destilada estéril. Se agregaron aproximadamente 4 kg del sustrato preparado en cada maceta. Además, se extrajo una muestra del sustrato para llevar a cabo los análisis fisicoquímicos correspondientes.
Inoculación de semillas de leguminosas con especies de HMA
Antes de la inoculación, las semillas de cada una de las leguminosas se desinfectaron con alcohol al 70% durante un minuto y se enjuagaron con agua destilada por cinco veces. Posteriormente, las semillas fueron tratadas con hipoclorito de sodio al 2% durante cinco minutos seguido de otro enjuague con agua destilada, esta vez repetido diez veces para asegurar la eliminación completa de residuos de hipoclorito de sodio. Conforme al diseño experimental, cada maceta fue sembrada con dos semillas de una de las cuatro especies de leguminosas seleccionadas. Cada par de semillas fue inoculado con 100 esporas de una de las tres especies de HMA en estudio. Este protocolo se repitió para cada tratamiento inoculado. Para asegurar un suministro adecuado de nutrientes durante el crecimiento de las plantas, se aplicaron 200 mL de la solución nutritiva de Hoagland, libre de fósforo (P), cada 30 días. Esta solución proporcionó los nutrientes esenciales, como nitrógeno (N), potasio (K), calcio (Ca), azufre (S) y magnesio (Mg), según las necesidades nutricio-nales de las plantas y de acuerdo con los resultados del análisis fisicoquímico del sustrato que se detalla en la Tabla 1. El riego de las unidades experimen-tales se llevó a cabo de manera interdiaria utilizando agua destilada, con el objetivo de mantener el suelo en capacidad de campo.
Variables evaluadas
Las variables fueron evaluadas al concluir el periodo fenológico de las leguminosas en el invernadero, C. ensiformis y V. unguiculata completaron su ciclo a los 60 días después de la siembra (DDS), mientras que C. cajan y C. juncea lo hicieron a los 120 DDS. Se tomaron datos de las variables para cada tratamiento y repetición.
La altura de las plantas se midió utilizando una regla metálica de 1 m, desde la base del tallo hasta el ápice de la planta.
El número de hojas se determinó contando todas las hojas de cada planta al finalizar su periodo fenológico.
Para determinar la biomasa seca de la parte aérea (BSPA), se procedió a cortar las plantas separando la parte aérea de las raíces. Posteriormente, las muestras de la parte aérea fueron colocadas dentro de sobres manila y luego introducidas en una estufa (Binder, ED115, Tuttlingen, Alemania) a una temperatura de 70 °C durante 48 horas. El peso seco de cada muestra se obtuvo mediante el uso de una balanza electrónica (AyD Weighing, EJ-610, Seúl, Corea del Sur), con una precisión de 0,01 g.
La dependencia de las leguminosas por los HMA en estudio, se determinó de acuerdo a la siguiente fórmula: Dependencia Micorrízica (%) = ((Peso de la BSPA de la planta micorrizada - Peso de la BSPA de la planta no micorrizada)/Peso seco de la BSPA de la planta micorrizada) x 100, tomando como referencia a Tawaraya (2003).
La determinación del porcentaje de colonización micorrízica de las raíces siguió los pasos descritos por Ríos-Ruiz et al. (2019). Primero, las muestras de raíces se lavaron y se trataron con una solución de KOH al 10% a 90 °C durante 40 minutos en un baño María (Selecta, Precisdig 12 L, Barcelona, España). Después, se clarificaron con H2O2 al 10%. A continuación, se tiñeron con tinta azul en un baño María (Selecta, Precisdig 12 L, Barcelona, España) a 90 °C durante 60 segundos. Las raíces teñidas se distribuyeron aleatoriamente en una placa Petri cuadriculada y se observaron bajo un estereo-microscopio binocular (Carl Zeiss, Stemi 305, Oberkochen, Alemania) para identificar las estructuras fúngicas de los HMA (hifas, vesículas, arbúsculos y esporas). Se registró la presencia o ausencia de colonización micorrízica en cada intersección de las raíces con la línea horizontal en la cuadrícula.
Finalmente, se calculó el porcentaje de coloni-zación micorrízica utilizando la fórmula:
% de colonización = (Número de segmentos colonizados/Número total de segmentos evaluados) x 100
El número de esporas de HMA se determinó de acuerdo a lo descrito por Ríos-Ruiz et al. (2019). Para ello se tamizó una muestra de 10 g del sustrato de cada tratamiento, utilizando tamices de 710 μm y 53 μm en secuencia.
Tabla 1
Propiedades físicas y químicas del sustrato utilizado para el crecimiento de las leguminosas de cobertura
|
Muestra |
pH |
CE |
N |
MO |
P |
K |
Análisis mecánico (%) |
Clases textural |
|||
|
µS/cm |
% |
% |
ppm |
ppm |
Arena |
Limo |
Arcilla |
|
|||
|
Sustrato |
6,1 |
154,3 |
0,172 |
3,43 |
8,9 |
119,10 |
19 |
44 |
37 |
Franco limo arcilloso |
|
Nota: Los análisis físicos y químicos del sustrato fueron realizados en el Laboratorio de Suelos y Aguas de la Facultad de Ciencias Agrarias de la Universidad Nacional de San Martín, utilizando las metodologías reportadas en Ríos-Ruiz et al. (2019). CE= Conductividad eléctrica, N= Nitrógeno, MO= Materia orgánica, P=Fósforo y K= Potasio.
Posteriormente, las esporas fueron resuspendidas en agua destilada y centrifugadas en centrífuga (Hettich, Rotofix 32 A, Tuttlingen, Alemania) a 3500 rpm durante 5 minutos. Se repitió este proceso dos veces utilizando una solución acuosa de sacarosa al 70%. Para el recuento de esporas, se tomaron 10 ml de cada muestra procesada, se depositaron en una placa concéntrica y se contaron utilizando un estereomicroscopio binocular (Carl Zeiss, Stemi 305, Oberkochen, Alemania) con un aumento de 40 veces.
Para determinar la concentración de fósforo foliar, se trituró la muestra de BSPA y se transfirió a microtubos. Luego, se llevó a cabo la evaluación utilizando la técnica de digestión ácida nítrica-perclórica y se midió la absorbancia a 600 nm.
Análisis estadístico
Los datos de altura de la planta y la BSPA se transformaron utilizando la función (√x), mientras que para el porcentaje de colonización y el contenido de fósforo foliar se aplicó la función angular Arcsen (√x%).
El análisis estadístico se realizó utilizando el software MINITAB 18. Se llevó a cabo un análisis de varianza y para comparar las medias entre tratamientos se empleó la prueba de Tukey, con un nivel de significancia establecido en p < 0,05, con el fin de determinar las diferencias significativas entre los tratamientos.
RESULTADOS Y DISCUSIÓN
Altura de la planta
El análisis de comparación de medias de Tukey (p < 0,05) (Tabla 2) reveló diferencias significativas en la altura de las plantas entre los diferentes tratamientos, cada uno constituido por una leguminosa y un HMA. Para los tratamientos que incluyeron C. cajan y HMA, se observó que la planta inoculada con Acaulospora sp. alcanzó una altura promedio de 168,67 cm, siendo la más alta entre este grupo. Por otro lado, C. ensiformis y HMA mostraron que la planta inoculada con A. rugosa alcanzó una altura promedio de 271,67 cm, la más destacada dentro de este grupo. En cuanto a los tratamientos con C. juncea y HMA, la planta inoculada con A. appendicula registró la mayor altura promedio con 235,33 cm. Finalmente, para V. unguiculata y HMA, la planta inoculada con A. rugosa alcanzó una altura promedio de 206,60 cm, siendo la más alta en comparación con las demás del mismo grupo. El uso de HMA ofrece una serie de ventajas para las plantas, como una mayor disponibilidad de agua y nutrientes, la mitigación de diversos estreses bióticos y abióticos, y el estímulo del crecimiento vegetal (Parihar et al., 2022). Sin embargo, la eficacia de los HMA en mejorar el rendimiento de las plantas está condicionada por varios factores adicionales, como la especificidad de las cepas de HMA y los genotipos de las plantas (Lanfranco et al., 2018; Nagaraj et al., 2021). Los HMA autóctonos están más adaptados a los suelos de una región específica, lo que los hace más adecuados para ciertos cultivos (Delavaux & Bever, 2022). Esta premisa se confirmó en el presente estudio al utilizar especies nativas de la región de San Martín. En el caso de C. cajan, se observó que esta leguminosa alcanzó una altura de 15,66% mayor cuando fue inoculada con Acaulospora sp. en comparación con A. rugosa. Por otro lado, C. ensiformes mostró un aumento de más del 20% en altura cuando fue inoculada con A. rugosa en comparación con Acaulospora sp.
Tabla 2
Valores promedio y parámetros estadísticos de las variables registradas en la evaluación de leguminosas de cobertura (Cajanus cajan, Canavalia ensiformis, Crotalaria juncea y Vigna unguiculata), inoculados con hongos micorrízicos arbusculares
|
Inoculante (HMA) |
Altura de la planta (cm) |
Número de hojas |
BSPA (g) |
Colonización micorrízica (%) |
Número de esporas |
Contenido de fósforo (%) |
|
Cajanus cajan |
||||||
|
166,33 (±3,68) a |
44,67 (±0,94) a |
22,65 (±0,56) a |
0 c |
0 d |
3,60 (±0,23) b |
|
|
Acalospora rugosa |
145,83 (±4,09) b |
48,00 (±1,63) a |
20,89 (±1,32) ab |
39,58 (±4,24) a |
210,00 (±5,10) b |
3,07 (±0,30) b |
|
Acaulospora sp. |
168,67 (±5,79 a |
42,00 (±0,82) a |
18,05 (±0,75) b |
27,49 (±1,86) b |
401,00 (±17,57) a |
3,19 (±0,15) b |
|
Ambispora appendicula |
161,00 (±5,35) a |
45,00 (±3,56) a |
20,22 (±1,35) ab |
25,28 (±1,58) b |
43,00 (±5,35) c |
5,01 (±0,13) a |
|
CV (%) |
1,83 |
2,77 |
3,17 |
7,15 |
3,75 |
3,80 |
|
Canavalia ensiformis |
||||||
|
Sin inoculante |
224,67 (±4,11) b |
9,00 (±0,82) a |
11,35 (±0,45) b |
0 c |
0 d |
2,64 (±0,01) a |
|
Acaulospora rugosa |
271,67 (±8,50) a |
12,67 (±1,70) a |
14,84 (±0,65) a |
34,40 (±14,64) ab |
173,30 (±24,53) b |
2,33 (±0,02) b |
|
Acaulospora sp. |
225,33 (±1,25) b |
10,33 (±1,89) a |
14,58 (±0,50) a |
55,86 (±10,77) a |
346,00 (±28,60) a |
2,49 (±0,03) ab |
|
Ambispora appendicula |
234,67 (±2,62) b |
10,67 (±0,47) a |
11,45 (±0,38) b |
23,42 (±6,47) b |
3,00 (±21,95) c |
2,35 (±0,19) ab |
|
CV (%) |
1,23 |
7,55 |
2,31 |
25,74 |
14,46 |
2,41 |
|
Crotalaria juncea |
||||||
|
Sin inoculante |
204,67 (±6,18) b |
108,00 (±2,83) b |
23,99 (±1,27) bc |
0 c |
0 d |
3,34 (±0,39) a |
|
Acaulospora rugosa |
166,00 (±6,48) c |
59,67 (±3,30) c |
22,51 (±0,55) c |
62,44 (±4,11) a |
349,67 (±8,96) a |
3,02 (±0,23) a |
|
Acaulospora sp. |
230,67 (±7,36) a |
149,33 (±4,19) a |
27,52 (±0,99) a |
28,70 (±8,63) b |
209,70 (±19,07) b |
3,38 (±0,20) a |
|
Ambispora appendicula |
235,33 (±7,76) a |
112,00 (±8,16) b |
26,43 (±1,15) ab |
21,38 (± 1,13) b |
15,00 (±2,16) c |
3,25 (±0,10) a |
|
CV (%) |
2,05 |
2,95 |
2,54 |
13,48 |
4,98 |
4,91 |
|
Vigna unguiculata |
||||||
|
Sin inoculante |
61,00 (±4,32) c |
7,33 (±1,89) b |
4,31 (±0,28) b |
0 c |
0 d |
3,08 (±0,20) b |
|
Acaulospora rugosa |
206,60 (±4,71) a |
10,00 (±0,00) ab |
9,35 (±0,36) a |
71,48 (±12,56) a |
301,67 (±14,08) b |
2,81 (±0,11) b |
|
Acaulospora sp. |
179,67 (±0,47) b |
12,00 (±0,82) a |
9,54 (±0,93) a |
50,27 (±6,82) ab |
600,33 (±12,47) a |
4,18 (±0,13) a |
|
Ambispora appendicula |
184,00 (±3,27) b |
13,33 (±0,94) a |
8,33 (±1,05) a |
30,18 (±3,62) b |
62,33 (±6,85) c |
3,00 (±0,45) b |
|
CV (%) |
1,72 |
7,16 |
5,67 |
16,89 |
3,16 |
5,11 |
HMA: Hongo micorrízico arbuscular. BSPA: Peso seco de la parte aérea. Los datos corresponden al promedio de tres repeticiones. Letras diferentes en cada columna denotan diferencias estadísticamente significativas con base en la prueba de Tukey (p < 0,05). CV: Coeficiente de Variabilidad.
Resultados similares de aumento significativo en la altura de C. ensiformis fueron reportados por Padrón-Rodríguez et al. (2020), quienes estudiaron la co-inoculación de HMA y hongos solubilizadores de fosfato, obteniendo mayor altura en comp-aración con los tratamientos no inoculados. En cuanto a C. juncea, esta leguminosa mostró una mayor altura cuando fue inoculada con A. appendicula (un aumento del 41,76%) en compa-ración con A. rugosa. Por último, V. unguiculata presentó una altura superior del 14,99% cuando fue inoculada con A. rugosa en comparación con Acaulosora sp. Las diferencias en la altura de las plantas observada entre los diferentes trata-mientos pueden explicarse por el grado variable de dependencia micorrízica de cada leguminosa, el cual está relacionado con el contenido de nutrientes del suelo como C, N y P (Burak et al., 2024). El sustrato utilizado en el presente estudio mantuvo una concentración adecuada de nutrien-tes durante todo el periodo fenológico de las leguminosas mediante la adición de solución nutritiva, con el fin de evitar que este factor limite el desarrollo de las plantas y para que las diferencias observadas dependan principalmente de la especificidad de los HMA y las características genotípicas de la planta.
Número de hojas
El análisis de comparación de medias de Tukey (p < 0,05) (Tabla 2) para el número de hojas de las plantas reveló resultados diversos entre los diferentes tratamientos. Para C. cajan, no se observaron diferencias significativas entre los tratamientos. En el caso de C. juncea, se encontró que la planta inoculada con Acaulospora sp. exhibió el mayor número de hojas, con un promedio de 149,33, diferenciándose estadísticamente de los demás tratamientos del mismo grupo. Por otro lado, tanto C. ensiformis como V. unguiculata no mostraron diferencias significativas en el número de hojas entre los diferentes tratamientos. Sin embargo, Padrón-Rodríguez et al. (2020) quienes utilizaron C. ensiformis y HMA, además de hongos solubilizadores de fosfato, si encontraron diferencias significativas en el número de hojas de las plantas inoculadas comparadas con las no inoculadas. Así mismo, Mpongwana, et al. (2023), quienes investigaron los efectos de HMA y la inoculación de Rhizobium en la composición química de tres leguminosas forrajeras herbáceas, entre ellas, V. unguiculata, encontraron que la inoculación dual produjo una acumulación óptima de nutrientes en las hojas en comparación con la inoculación única y los forrajes no inoculados. Por lo tanto, este parámetro permite tener elementos para comprender cómo la simbiosis afecta el crecimiento de las plantas, su salud y su rendimiento, lo que a su vez puede ayudar a mejorar la producción agrícola y la sostenibilidad del ecosistema.
Biomasa seca de la parte aérea (BSPA)
El análisis de comparación de medias de Tukey (p < 0,05) (Tabla 2) para la BSPA de las plantas reveló resultados significativos en los diferentes tratamientos. En el caso de C. cajan, se observó que la planta sin inoculante registró la mayor BSPA, alcanzando 22,65 g. En cuanto a C. ensiformis, la planta inoculada con A. rugosa presentó la mayor BSPA, alcanzando 14,84 g. Para C. juncea, la planta inoculada con A. appendicula mostró la mayor BSPA, con un promedio de 26,43 g. Por último, para V. unguiculata, la planta inoculada con A. rugosa registró la mayor BSPA, con un promedio de 9,35 g.
Nuestros resultados muestran que los HMA contribuyen a mejorar la absorción de nutrientes y por tanto el incremento de la biomasa de las plantas, la cual varía en función de la dependencia de estas con el tipo de HMA con el cual establecen la simbiosis. Nagaraj et al. (2021) encontraron que la dependencia de las plantas varió significativamente entre los genotipos de C. cajan oscilando entre 30,54% y 65,02%, lo cual contribuyó a generar mayor biomasa en plantas micorrizas. Por el contrario, en nuestro estudio no se observó dependencia de esta leguminosa con ninguno de los HMA utilizados como inoculantes, más aún tuvo una dependencia negativa (Figura 2). Sin embargo, C. ensiformis presentó dependencia con A. rugosa (23,32%), Acaulospora sp. (22,01%) y muy baja con A. appendicula (0,71%). Así mismo, C. juncea presentó dependencia con los hongos Acaulospora sp. (12,71%) y A. appendicula (9,04%). Por su parte, V. unguiculata fue la que mayor dependencia micorrízica presentó, alcanzando con A. rugosa 53,86%, con Acaulospora sp. 54,40% y con A. appendicula 47,37% (Figura 2).
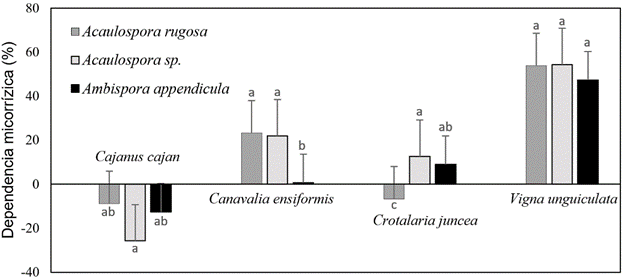
Figura 2. Distribución de la dependencia micorrízica de leguminosas de cobertura con hongos micorrízicos arbusculares. Las barras con letras diferentes son significativamente diferentes (Tukey (p < 0,05). Las líneas sobre las barras expresan la desviación estándar.
La magnitud del cambio en el crecimiento de las plantas, asociado con la colonización de los HMA, se expresa como la dependencia micorrízica (Tawaraya, 2003). Dado este principio, es importante llevar a cabo una cuidadosa selección de especies y cultivares de plantas hospedantes eficaces a fin de no tener una dependencia negativa, como lo ocurrido en el presente estudio con la interacción C. cajan y los tres HMA evaluados (Figura 2). Las variedades deben ser elegidas en condiciones en las que los endófitos micorrícicos estén plenamente establecidos. Es fundamental mejorar los cultivares altamente micotróficos e integrarlos en sistemas de bajos insumos para fomentar el uso sostenible de los nutrientes a través de la simbiosis con HMA.
Colonización micorrízica
El análisis de comparación de medias de Tukey (p < 0,05) (Tabla 2) para la colonización micorrízica de las plantas reveló resultados distintos entre los tratamientos. Para C. cajan, se observó que la planta inoculada con A. rugosa mostró la mayor colonización micorrízica, alcanzando un porcentaje de 39,58%. Por otro lado, para C. ensiformis, el tratamiento con la mayor colonización micorrízica correspondió a la planta inoculada con Acaulospora sp., presentando un porcentaje de 55,86%. En el caso de C. juncea, la mayor colonización micorrízica se registró en la planta inoculada con A. rugosa, con un porcentaje de 62,44%. Finalmente, en V. unguiculata, la planta inoculada con A. rugosa exhibió la mayor colonización micorrízica, alcanzando un porcentaje de 71,48%. Cabe mencionar que los tratamientos testigos no presentaron colonización micorrízica, mostrando que no fueron contaminados. En la Figura 3 se muestran las estructuras de hifas, esporas y vesículas observadas en el presente estudio.

Figura 3. Estructuras de colonización micorrízica en leguminosas de cobertura. Se observa la presencia de hifas, esporas y vesículas.
Resultados similares con una alta colonización micorrízica (superiores al 60%) también fueron encontrados por García Rubido et al. (2017) quienes evaluaron la interacción de C. ensiformis y diferentes HMA alcanzando entre 36% y 58,45% de colonización micorrízica. Así mismo, Ríos-Ruiz et al. (2019) al estudiar la capacidad micotrófica y diversidad de HMA nativos aislados de suelos degradados de la región San Martin y que fueron utilizados en el presente estudio, encontraron que V. unguiculata presentó el mayor porcentaje de colonización micorrízica (75%), seguido de C. juncea y C. ensiformis que no difirieron entre sí, en comparación con C. cajan la cual presentó la menor colonización (52,68%). Los autores destacan que los altos niveles de colonización encontrados pueden estar vinculados a la adaptación de los HMA nativos al bajo pH y a la menor cantidad de fósforo disponible presente en los suelos de las zonas estudiadas. Por su parte, Padrón-Rodríguez et al. (2020) quienes estudiaron la co-inoculación de HMA y hongos solubilizadores de fosfato en simbiosis con C. ensiformis encontraron también una alta colonización de las raíces (entre 64% y 85,7%) al final del periodo fenológico de la planta. Por otro lado, Arma et al. (2019) evaluaron la colonización de raíces por HMA en diferentes plantas hospedantes, entre ellas C. cajan, y encontraron un porcentaje de 27,98% al ser inoculada con Acaulospora sp. Del mismo modo, Nagaraj et al. (2021) encontraron una alta coloni-zación de las raíces de diferentes genotipos de C. cajan variando entre 40% y 78,67%. Estos resultados sugieren que la efectividad de una cepa de HMA se manifiesta por su capacidad para colonizar a la planta huésped e influir de forma positiva en su crecimiento, desarrollo, contenido de nutrientes y rendimiento, favoreciendo así mismo la multiplicación de los propágulos (hifas y esporas) de las cepas en el suelo.
Número de esporas
El análisis de comparación de medias de Tukey (p < 0,05) (Tabla 2) para el número de esporas de las plantas reveló resultados significativos entre los diferentes tratamientos. En el caso de C. cajan, se observó que la planta inoculada con Acaulospora sp. registró el mayor número de esporas, alcanzando un total de 401 esporas. En cuanto a C. ensiformis, la planta inoculada con Acaulospora sp. presentó el mayor número de esporas, con un total de 346 esporas. Para C. juncea, la planta inoculada con A. rugosa mostró el mayor número de esporas, con un promedio de 349,67 esporas. Finalmente, en V. unguiculata, la planta inoculada con Acaulospora sp. exhibió el mayor número de esporas, alcanzando un promedio de 600,33 esporas.
Los resultados muestran que todas las leguminosas son altamente micotróficas ya que todas incremen-taron considerablemente el número de esporas. Resultados similares fueron reportados por García Rubido et al. (2017), quienes encontraron 333 esporas por 50 g de suelo en la interacción de C. ensiformis y el HMA Glomus cubense. Por otra parte, en el estudio de Ríos-Ruiz et al. (2019) se identificaron diferencias significativas en el número de esporas entre C. cajan, C. ensiformis, C. juncea y V. unguiculata. Es importante destacar que, en dicho estudio, las leguminosas fueron empleadas únicamente como plantas trampa para la multiplicación de las esporas. En contraste, nuestro estudio actual se enfocó en determinar la compatibilidad y dependencia de tres de los HMA que presentaron la mayor abundancia de esporas en el trabajo previo realizado por Ríos-Ruiz et al. (2019). Por otro lado, Arma et al. (2019) evaluaron el número de esporas de HMA en diferentes plantas hospedantes, entre ellas C. cajan, y encontraron 30 esporas por 50 g de suelo al ser inoculada con Acaulospora sp. La notable variabilidad en la abundancia de esporas de HMA en un determinado suelo surge como resultado de una interacción compleja entre diversos factores bióticos y abióticos característicos de cada entorno (Wahab et al., 2023). La especificidad de la relación planta-HMA se refleja en la preferencia de ciertas especies de plantas por asociarse con determinadas cepas de HMA, lo que puede influir en la abundancia y diversidad de esporas presentes en el suelo, como lo ocurrido en el presente estudio. La proliferación y la viabilidad de las esporas de HMA en el suelo, por lo tanto, son aspectos críticos para mantener la salud y la productividad de los ecosistemas terrestres.
Contenido de fósforo foliar
El análisis de comparación de medias de Tukey (p < 0,05) (Tabla 2) reveló diferencias significativas en el contenido de fósforo foliar entre los diferentes tratamientos, Para C. cajan, la planta inoculada con A. appendicula destacó al alcanzar la mayor concentración de fósforo foliar, registrando un 5,01%. Por otro lado, C. ensiformis exhibió la mayor concentración de fósforo foliar en la planta sin inoculante, alcanzando un 2,64%. En el caso de C. juncea, la planta inoculada con Acaulospora sp. mostró la mayor concentración de fósforo foliar, con un 3,38%. Finalmente, V. unguiculata registró la mayor concentración de fósforo foliar en la planta Acaulospora sp. con un 4,18%.
Según Arruda et al. (2021), el fósforo, en suelos tropicales, es uno de los nutrientes más limitantes para el rendimiento de los cultivos debido a su baja movilidad, estos autores demostraron que los cultivos de cobertura afectaron el ciclo del fósforo en las capas más profundas del suelo, indicando que estos cultivos pueden aumentar el potencial de inóculo de micorrizas arbusculares para el cultivo siguiente en rotación o cultivos intercalados, cuando se utilizan como abono verde. En nuestro estudio las especies de HMA, A. appendicula y Acaulospora sp, aumentaron significativamente el contenido de fósforo foliar en C. cajan y V. unguiculata respectivamente. Wu et al. (2023) examinaron cómo los HMA afectan la relación de nutrientes N: P: K en las hojas, descubriendo que esta está relacionada con diferentes aspectos como, las especies vegetales, el ciclo de vida y los hábitos de crecimiento, así como la identificación de los HMA. La capacidad de absorción y utilización de P son diferentes entre especies de plantas y cultivares (Adeyemi et al., 2021).
Los resultados obtenidos en el presente estudio revelan consistentemente diferencias positivas significativas entre la mayoría de los tratamientos de leguminosas inoculadas con respecto a las no inoculadas en los diferentes parámetros estudiados. La altura de la planta, el número de hojas, la biomasa seca de la parte aérea y el contenido de fósforo foliar, fueron, en la mayoría de los casos, superiores en las plantas inoculadas en comparación con las no inoculadas. Estos hallazgos sugieren que la asociación con HMA mejora significativamente el crecimiento y el rendimiento de las plantas leguminosas, lo que respalda la importancia de esta simbiosis para la nutrición y el desarrollo vegetal. Además, observamos diferencias en el porcentaje de colonización micorrízica y en el número de esporas entre los diferentes tratamientos inoculados. Estas variaciones reflejan el grado de especificidad y la dependencia de la relación planta-HMA, donde ciertas especies de leguminosas presentan mayor afinidad por ciertos tipos de HMA, lo que resulta en una colonización más efectiva y una mayor producción de esporas. Estos resultados subrayan la importancia de considerar la diversidad de HMA y la dependencia de la asociación en los programas de inoculación para maximizar los beneficios de las leguminosas de cobertura.
CONCLUSIONES
Estos resultados resaltan los beneficios claros de la asociación entre leguminosas de cobertura y HMA en la mejora del crecimiento vegetal y la disponibilidad de nutrientes en suelos degradados. Se sugiere que estudios futuros exploren aún más estas asociaciones y sus efectos en la recuperación de suelos degradados, con el fin de establecer programas de manejo de suelos más eficaces y sostenibles.
Nuestro agradecimiento al Consejo Nacional de Ciencia y Tecnología (CONCYTEC) (Convenio 150-2015-FONDECYT) por el aporte financiero recibido, y a la Universidad Nacional de San Martín, como entidad ejecutora, por el apoyo para el desarrollo del proyecto de investigación "Restauración de suelos degradados por agricultura migratoria usando microorganismos benéficos asociados a plantas de cobertura en la zona de protección de la subcuenca del Cumbaza, en San Martín". Este artículo de investigación, derivado de la tesis "Compatibilidad funcional entre especies de leguminosas de cobertura y hongos micorrízicos arbusculares bajo condiciones de invernadero en la región de San Martín", realizada por Luz Elizabeth Valdiviezo Saavedra, sustentada el 11-10-2021, fue llevado a cabo en el contexto del proyecto financiado por CONCYTEC. Un agradecimiento especial a la Sra. CPC. Beatriz Reátegui Ruiz por su apoyo en la redacción y edición del manuscrito.
REFERENCIAS BIBLIOGRÁFICAS
Adeyemi, N. O., Atayese, M. O., Sakariyawo, O. S., Azeez, J. O., Olubode, A. A., Ridwan, M., Adebiyi, A., Oni, O., & Ibrahim, I. (2021). Influence of different arbuscular mycorrhizal fungi isolates in enhancing growth, phosphorus uptake and grain yield of soybean in a phosphorus deficient soil under field conditions. Communications in Soil Science and Plant Analysis, 52(10), 1171-1183. https://doi.org/10.1080/00103624.2021.1879117
Arma, M. J., Rakian, T. C., Tufaila, M., Rembon, F. S., Hisein, W. S. A., & Kandari, A. M. (2019). Propagation spores of arbuscular mycorrhiza fungi and rooting colonization characteristic’s on different host plants. GSC Biological and Pharmaceutical Sciences, 8(1). https://doi.org/10.30574/gscbps.2019.8.1.0114
Arruda, B., Bejarano-Herrera, W. F., Rojas-García, J. C., Turner, C., & Pavinato, P. S. (2021). Cover crop species and mycorrhizal colonization on soil phosphorus dynamics. Rhizosphere, 19, 100396. https://doi.org/10.1016/j.rhisph.2021.100396
Brito, I., Carvalho, M., & Goss, M. J. (2021). Managing the functional diversity of arbuscular mycorrhizal fungi for the sustainable intensification of crop production. Plants, People, Planet, 3(5), 491-505. https://doi.org/10.1002/ppp3.10212
Burak, K., Yanardağ, İ. H., Gómez-López, M. D., Faz, Á., Yalçin, H., Sakin, E., Ramazanoğlu, E., Orak, A. B., & Yanardağ A. (2024). The effect of arbuscular mycorrhizal fungi on biological activity and biochemical properties of soil under vetch growing conditions in calcareous soils. Heliyon, 10(3), e24820. https://doi.org/10.1016/j.heliyon.2024.e24820
Chippano, T., Mendoza, R., Cofré, N., & García, I. (2022). Arbuscular mycorrhizal fungi improve legume seedling performance as the competition with conspecific neighbouring adult plants decreases. Rhizosphere, 22, 100509. https://doi.org/10.1016/j.rhisph.2022.100509
Davison, J., García de León, D., Zobel, M., Moora, M., Bueno, C. G., Barceló, M., Gerz, M., León, D., Meng, Y., Pillar, V. D., Sepp, S. K., Soudzilovaskaia, N. A., Tedersoo, L., Vaessen, S., Vahter, T., Winck, B., & Öpik, M. (2020). Plant functional groups associate with distinct arbuscular mycorrhizal fungal communities. New Phytologist, 226, 1117–1128. https://doi.org/10.1111/nph.16423
Delavaux, C. S., & Bever, J. D. (2022). Evidence for the evolution of native plant response to mycorrhizal fungi in post-agricultural grasslands. Ecology and Evolution, 12(7), e9097. Https://doi.org/10.1002/ece3.9097
Diagne, N., Ngom, M., Djighaly, P. I., Fall, D., Hocher, V., & Svistoonoff, S. (2020). Roles of Arbuscular Mycorrhizal Fungi on Plant Growth and Performance: Importance in Biotic and Abiotic Stressed Regulation. Diversity, 12, 370. https://doi.org/10.3390/d12100370
García Rubido, M., Rivera Espinosa, R., Cruz Hernandez, Y., Acosta Aguiar, Y., & Ramón Cabrera, J. (2017). Respuesta de Canavalia ensiformis (L.) a la inoculación con diferentes cepas de hongo micorrízico arbuscular en un suelo FARL. Cultivos Tropicales, 38(1), 7-12.
Herath, B. M., Kalamulla, K. W. Y. R., Mayadunna, T. A. N., Perera, M. A. E. G., Jayamanna, I. K., & Yapa, P. N. (2024). Applications of Arbuscular Mycorrhizal Fungi for Sustainable Agricultural Systems. In: Ahammed, G.J., Hajiboland, R. (eds) Arbuscular Mycorrhizal Fungi and Higher Plants. Springer, Singapore. https://doi.org/10.1007/978-981-99-8220-2_14
Islam, W., Zeng, F., Alotaibi, M. O., & Khan, K. A. (2024). Unlocking the potential of soil microbes for sustainable desertification management. Earth-Science Reviews, 252, 104738. https://doi.org/10.1016/j.earscirev.2024.104738
Jena, J., Maitra, S., Hossain, A., Pramanick, B., Gitari, H. I., Praharaj, S., Shankar, T., Palai, J. B., Rathore, A., Mandal, T. K., & Jatav, H. S. (2022). Role of legumes in cropping system for soil ecosystem improvement. Ecosystem services: types, management and benefits. Nova Science Publishers, Inc, New York, 1-22.
Kopittke, P. M., Menzies, N. W., Wang, P., McKenna, B. A., & Lombi, E. (2019). Soil and the intensification of agriculture for global food security. Environment International, 132, 105078. https://doi.org/10.1016/j.envint.2019.105078
Lanfranco, L., Fiorilli, V., & Gutjahr, C. (2018). Partner communication and role of nutrients in the arbuscular mycorrhizal symbiosis. New Phytologist, 220(4), 1031–1046. https://doi.org/10.1111/nph.15230
Miyata, K., & Umehara, M. (2024). Roles of Arbuscular Mycorrhizal Fungi for Essential Nutrient Acquisition Under Nutrient Deficiency in Plants. In: Ahammed, G.J., Hajiboland, R. (eds) Arbuscular Mycorrhizal Fungi and Higher Plants. Springer, Singapore. https://doi.org/10.1007/978-981-99-8220-2_6
Mpongwana, S., Manyevere, A., Mupangwa, J., Mpendulo, C. T., & Mashamaite, C. V. (2023) Foliar nutrient content responses to bio-inoculation of arbuscular mycorrhizal fungi and Rhizobium on three herbaceous forage legumes. Frontiers in Sustainable Food Systems, 7, 1256717. https://doi.org/10.3389/fsufs.2023.1256717
Nagaraj, K., Vanishree, S., & Muthukumar, T. (2021). Genotypic variation in response and dependency of Cajanus cajan (L.) Millsp., on arbuscular mycorrhizal fungi in a tropical Alfisol. Plant Biosystems-An International Journal Dealing with All Aspects of Plant Biology, 155(4), 878-890. https://doi.org/10.1080/11263504.2020.1810802
Padrón-Rodríguez, L., Arias-Mota, R. M., Medel-Ortíz, R., & la Cruz-Elizondo, D. (2020). Interaction with arbuscular mycorrhizal and phosphate solubilizer fungi in Canavalia ensiformis (Fabaceae). Botanical Sciences, 98(2), 278-287. https://doi.org/10.17129/botsci.2476
Parihar, M., Chitara, M. K. Ram, H., Kumari, A., Tiwari, G., Rana, K., Gorain, B., Kumar, U., Bisht, J. K., & Kant L. (2022). Role of AM fungi in growth promotion of high-value crops. Chapter 5. In: New and future developments in microbial biotechnology and bioengineering: Sustainable agriculture: Advances in microbe-based biostimulants. Eds. H. B. Singh, A. Vaishnav. Elsevier, 121–144. https://doi.org/10.1016/B978-0-323-85577-8.00018-4
Ríos-Ruiz, W. F., Barrios-López, L., Rojas-García, J. C., & Valdez-Nuñez, R. A. (2019). Mycotrophic capacity and diversity of native arbuscular mycorrhizal fungi isolated from degraded soils. Scientia Agropecuaria, 10(1), 99-108. https://doi.org/10.17268/sci.agropecu.2019.01.11
Salomon, M. J., Demarmels, R., Watts-Williams, S. J., McLaughlin, M. J., Kafle, A., Ketelsen, C., Soupir, A., Bücking, H., Cavagnaro, T. R., & Van Der Heijden, M. G. A. (2022). Global evaluation of commercial arbuscular mycorrhizal inoculants under greenhouse and field conditions. Applied Soil Ecology, 169, 104225. https://doi.org/10.1016/j.apsoil.2021.104225
Tawaraya, K. (2003). Arbuscular Mycorrhizal Dependency of Different Plant Species and Cultivars. Soil Science and Plant Nutrition, 49(5), 655–668. https://doi.org/10.1080/00380768.2003.10410323
Wahab, A., Muhammad, M., Munir, A., Abdi, G., Zaman, W., Ayaz, A., & Khizar, C. (2023). Reddy SPP. Role of Arbuscular Mycorrhizal Fungi in Regulating Growth, Enhancing Productivity, and Potentially Influencing Ecosystems under Abiotic and Biotic Stresses. Plants, 12(17), 3102. https://doi.org/10.3390/plants12173102
Wu, S., Shi, Z., Huang, M., Li, Y., & Gao, J. (2023). Effects of Arbuscular Mycorrhizal Fungi on Leaf N: P: K Stoichiometry in Agroecosystem. Agronomy, 13(2), 358. https://doi.org/10.3390/agronomy13020358