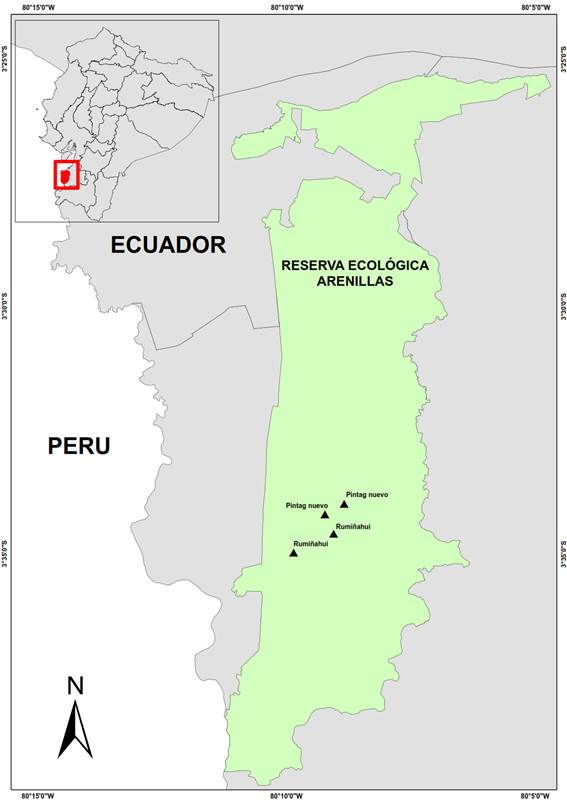
Se registraron un total de 122 especies,
distri-buidas en 22 familias (Figura 1), y 57 géneros en 514 árboles. Lo que
demuestra la gran diversidad de los bosques secos de la Reserva Ecológica
Arenillas, en comparación con los estudios de Lücking et al. (2019) que
reportaron 61 líquenes en remanentes de bosque tropical estacionalmente seco
(BTS) en Colombia, García-Martínez & Mercado-Gómez (2020) que reportaron 92
especies de líquenes en bosque seco tropical en los Montes de María, Sucre en
Colombia; y finalmente, Rosabal & Aragón (2010) que reportaron un total de
36 especies en matorrales secos.
Las familias con mayor número de especies
fueron Graphidaceae 34 especies, Roccellaceae, Physciaceae y Arthoniacaeae con
19, 16 y 12 especies respectivamente (Figura 2). Siguiendo el mismo patrón en
los bosques secos de Colombia se han determinado que la familia Graphidaceae
(12 especies) y Arthoniacaeae (10 especies) son las más diversas (Lücking et
al., 2019).
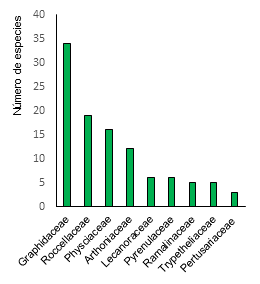
Figura 2. Representación de las familias indicadoras de
bosques secos.
Los géneros más representativos
fueron Graphis y Phaeographis con 9 especies, seguido de Dirinaria
con 8 especies y Arthonia 6 especies (Figura 3). Todos los demás géneros
presentaron valores menores a 5 especies. Los géneros de tipo crustáceo como Graphis,
Phaeographis y Arthonia han sido reportados como los más
abundantes en los bosques secos (Rosabal & Aragón, 2010; Lücking et al.,
2019; García-Martínez & Mercado-Gómez, 2020)
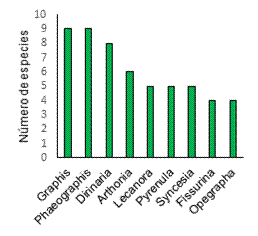
Figura 3. Géneros más
representativos de bosques secos.
El tipo de crecimiento con mayor
presencia en bosques secos fue el crustáceo con un total de 105 especies,
seguido del crecimiento folioso con 15 especies, mientras el fruticuloso y
gelatinoso presentaron una especie (Figura 4). Este patrón es consistente con
Rosabal & Aragón (2010) que reportaron una dominancia del tipo de
crecimiento crustáceo con 29 especies y Lücking et al. (2019) reporta 53
especies de líquenes crustáceos, lo que confirma una dominancia de líquenes
crustáceos en los bosques secos. En cuanto a los líquenes foliosos, gelatinosos
y fruticulosos los diferentes estudios han documentado un número menor de
especies para los bosques secos tropicales.
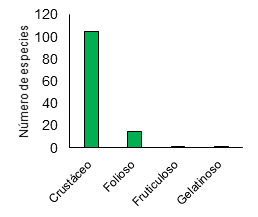
Figura 4. Formas de crecimiento de líquenes en bosques
secos.
Se detectaron un total de 30
especies de líquenes epífitos como indicadoras de los bosques secos (Tabla 1).
Así mismo las especies con valor mayor de indicación (>10) y que pueden
sugerirse para caracterizar bosque seco fueron Chrysothrix xanthina,
Coniocarpon cinnabarinum, Dirinaria picta, Graphis subcontorta, Lecanora helva,
Leucodecton occultum, Opegrapha difficilior, Pyrenula ochraceoflava, Pyrenula
erumpens, Pyrenula subcongruens, Pyxine cocoës, Syncesia leprobola y Trypethelium
eluteriae (Figura 5).
La mayor parte de especies
indicadoras de los bosques secos corresponden a líquenes crustáceos, donde solo
dos especies de tipo folioso se ha determinado como indicadora de los bosques
secos (Dirinaria picta y Pyxine cocoës). En este contexto,
estudios previos han documentado que las especies de líquenes con habito
crustáceo y foliosos con lóbulos estrechos son indicadoras de bosques con mayor
entrada de luz, debido a que la presencia de metabolitos secundarios que les dan
protección (Koch et al., 2013; Benítez et al., 2018).
Corroborando nuestros resultados,
Benítez et al. (2024a, b) señalan que los líquenes crustáceos son los mejores
indicadores en bosques secos y salitrales de Ecuador, pero también los estudios
en bosques secos de Colombia han confirmado que los líquenes con está forma de
crecimiento pueden ser seleccionados como indicadores de los bosques secos (Lücking
et al., 2019)
|
 Coniocarpon cinnabarinum Coniocarpon cinnabarinum
|
 Chrysothrix xanthina Chrysothrix xanthina
|
|
|
|
|
 Dirinaria picta Dirinaria picta
|
 Leucodecton occultum Leucodecton occultum
|
|
|
|
|
 Opegrapha difficilior Opegrapha difficilior
|
 Pyrenula ochraceoflava Pyrenula ochraceoflava
|
|
|
|
|
 Pyxine cocoës Pyxine cocoës
|
 Syncesia leprobola Syncesia leprobola
|
Figura 5. Especies con mayor valor de indicación de líquenes en bosques
secos.
Los líquenes crustáceos con apotecio en
forma de lirela (Graphis) son más comunes en bosques secundarios con
dosel abierto, debido a que presentan lirelas cerradas y de color negro que les
brindan tolerancia a intensidades de luz elevadas y ambientes secos (Kappen,
1988; Lücking, 1999; Koch et al., 2013; Benítez et al., 2018). Por otra parte,
los líquenes foliosos con lóbulos estrechos como Dirinaria picta y Pyxine
cocoës son más heliófilas, ocupando lugares con altos niveles de
irradiancia y estrés hídrico (Aragón et al., 2010; Rosabal & Aragón, 2010; Benítez et
al., 2012; Koch et al., 2013; Li et al., 2015; Benítez et al., 2018).
Tabla 1
Especies de líquenes indicadoras en bosques
secos.
|
Especie
|
Valor de
indicación
|
P valor
|
|
Bactrospora denticulata (Vain.) Egea
& Torrente
|
6
|
0,0001
|
|
Caloplaca wrightii (Willey) Fink.
|
4
|
0,0147
|
|
Chapsa diploschistoides (Zahlbr.)
Frisch
|
4,7
|
0,0231
|
|
Chrysothrix sp.
|
5,1
|
0,0001
|
|
Chrysothrix xanthina (Vain.) Kalb
|
16,9
|
0,0001
|
|
Coniocarpon cinnabarinum DC.
|
50,6
|
0,0001
|
|
Dirinaria aegialita (Afz.) B.
Moore
|
3
|
0,0038
|
|
Dirinaria picta (Sw.) Clem. & Shear
|
16,5
|
0,049
|
|
Enterographa compunctula (Nyl.)
Redinger
|
5
|
0,0221
|
|
Graphis anfractuosa (Eschw.) Eschw.
|
6,2
|
0,0563
|
|
Graphis dendrogramma Nyl.
|
9,9
|
0,024
|
|
Graphis subcontorta (Müll. Arg.) Lücking & Chavez
|
19,8
|
0,0003
|
|
Lecanora helva Stizenb.
|
16,5
|
0,049
|
|
Leucodecton occultum (Eschw.) A. Frisch.
|
22,9
|
0,0012
|
|
Opegrapha difficilior Nyl.
|
13,7
|
0,0064
|
|
Phaeographis brasiliensis (A. Massal.) Kalb &
Matthes-Leicht.
|
7,9
|
0,0202
|
|
Phyllopsora sp.
|
20,9
|
0,0007
|
|
Physcia sorediosa (Vain.) Lynge.
|
9,5
|
0,0433
|
|
Polymeridium pyrenuloides (Müll.Arg.)
Aptroot
|
7,4
|
0,0043
|
|
Pyrenula erumpens R. C. Harris
|
16,5
|
0,0003
|
|
Pyrenula immissa (Stirt.) Zahlbr.
|
8,9
|
0,0029
|
|
Pyrenula ochraceoflava (Nyl.) R.C. Harris
|
10,6
|
0,0059
|
|
Pyrenula subcongruens Müll.Arg.
|
22,2
|
0,008
|
|
Pyrenula subcongruens Müll.Arg.
|
13,7
|
0,0002
|
|
Pyxine cocoës (Sw.) Nyl.
|
13,1
|
0,0001
|
|
Ramalina darwiniana var. darwiniana
Aptroot & Bungartz
|
3
|
0,0043
|
|
Sarcographa tricosa (Ach.) Müll. Arg.
|
9,9
|
0,0331
|
|
Stirtonia ramosa Makhija & Patw.
|
10,8
|
0,0039
|
|
Syncesia leprobola Nyl. ex Tehler
|
32,5
|
0,0001
|
|
Trypethelium eluteriae Spreng.
|
12,3
|
0,0002
|
Aguirre, Z.,
Kvist, L. P., & Sánchez, O. (2006). Bosques secos
en Ecuador y su diversidad. Botánica económica de los Andes Centrales, 2006,
162-187.
Aragón, G.,
Martínez, I., Izquierdo, P., Belinchón, R., & Escudero, A. (2010). Effects of
forest management on epiphytic lichen diversity in Mediterranean forests. Applied
Vegetation Science, 13(2), 183-194.
Benítez, Á., Prieto,
M., & Aragón, G. (2015). Large trees and dense canopies: key factors for
maintaining high epiphytic diversity on trunk bases (bryophytes and lichens) in
tropical montane forests. Forestry: An International Journal of Forest
Research, 88(5), 521-527.
Benítez, Á.,
Aragón, G., & Prieto, M. (2019). Lichen diversity on tree trunks in
tropical dry forests is highly influenced by host tree traits. Biodiversity
and Conservation, 28(11), 2909-2929.
Benítez, A.,
Aragón, G., González, Y., & Prieto, M. (2018). Functional traits of
epiphytic lichens in response to forest disturbance and as predictors of total
richness and diversity. Ecological Indicators, 86,
18-26.
Benítez, Á.,
Prieto, M., González, Y., & Aragón, G. (2012). Effects of
tropical montane forest disturbance on epiphytic macro-lichens. Science
of the Total Environment, 441, 169-175.
Benítez, Á.,
Ortiz, J., Matamoros-Apolo, D., Bustamante, A., López, F., Yangua-Solano, E.,
& Gusmán-Montalván, E. (2024a). Forest Disturbance Determines
Diversity of Epiphytic Lichens and Bryophytes on Trunk Bases in Tropical Dry
Forests. Forests, 15(9), 1565.
Benítez, Á.,
Cruz, D., López, F., Cumbicus, N., Naranjo, C., Riofrío, M., ... & Vega, M.
(2024b). Epiphytic Lichens in Salt Flats as Biodiversity Refuges in Reserva
Ecológica Arenillas. Diversity, 16(11), 655.
Best, B., &
Kessler, M. (1995). Biodiversity and conservation in Tumbesian Ecuador
and Peru. International Council for Bird Preservation.
Brodo, I. M.,
Sharnoff, S. D., & Sharnoff, S. (2001). Lichens of north America.
Yale University Press.
Cerón, C.,
& Reyes, C. (2006). Características botánicas
de la Reserva Militar y Ecológica Arenillas, El Oro-Ecuador. Cinchonia, 7(1),
115-130.
Core, R.
(2015). Team. R: a language and environment for statistical computing, 2021.
Cueva Ortiz,
J., Espinosa, C. I., Quiroz Dahik, C., Aguirre Mendoza, Z., Cueva Ortiz, E.,
Gusmán, E., ... & Hildebrandt, P. (2019). Influence of anthropogenic factors
on the diversity and structure of a dry forest in the Central Part of the Tumbesian
Region (Ecuador–Perú). Forests, 10(1),
31.
de la
Rosa-Manzano, E., Andrade, J. L., Zotz, G., & Reyes-García, C. (2014). Epiphytic
orchids in tropical dry forests of Yucatan, Mexico–Species occurrence,
abundance and correlations with host tree characteristics and environmental
conditions. Flora-Morphology, Distribution, Functional Ecology of
Plants, 209(2), 100-109.
Dufrêne, M.,
& Legendre, P. (1997). Species assemblages and indicator species: the need
for a flexible asymmetrical approach. Ecological
monographs, 67(3), 345-366.
Escribano-Ávila,
G. (2016). El bosque seco neotropical de la provincia Ecuatoriana: un pequeño
gran desconocido. Ecosistemas, 25(2), 1-4.
Florin, A. D.
L., Asanza, A. W. S., Maza, J. E. M., & Figueroa, J. E. C. (2022 b). Índices
de diversidad florística forestal en la Reserva Ecológica Arenillas. Revista
Científica Agroecosistemas, 10(1), 96-103.
García-Martínez,
S., & Mercado-Gómez, J. D. (2020). Contribution to lichen microbiota of
the colombian tropical dry forest (Montes de María, Sucre). Ciencia
en Desarrollo, 11(2), 43-52.
Jüriado, I.,
Kämärä, M. L., & Oja, E. (2016). Environmental factors and ground
disturbance affecting the composition of species and functional traits of
ground layer lichens on grey dunes and dune heaths of Estonia. Nordic
Journal of Botany, 34(2), 244-255.
Kappen, L.
(1988). Ecophysiological relationships in different climatic regions. Handbook
of lichenology, 2, 37-100.
Koch, N. M., de
Azevedo Martins, S. M., Lucheta, F., & Müller, S. C. (2013). Functional
diversity and traits assembly patterns of lichens as indicators of successional
stages in a tropical rainforest. Ecological indicators, 34,
22-30.
Li, S., Liu, W.
Y., Li, D. W., Song, L., Shi, X. M., & Lu, H. Z. (2015). Species richness
and vertical stratification of epiphytic lichens in subtropical primary and
secondary forests in southwest China. Fungal Ecology, 17,
30-40.
Linares-Palomino,
R., Kvist, L. P., Aguirre-Mendoza, Z., & Gonzales-Inca, C. (2010). Diversity and
endemism of woody plant species in the Equatorial Pacific seasonally dry
forests. Biodiversity and Conservation, 19, 169-185.
Linares-Palomino,
R., Oliveira-Filho, A. T., & Pennington, R. T. (2011). Neotropical
seasonally dry forests: diversity, endemism, and biogeography of woody
plants. Seasonally dry tropical forests: ecology and conservation,
3-21.
Lucheta, F.,
Koch, N. M., Käffer, M. I., Riegel, R. P., de Azevedo Martins, S. M., &
Schmitt, J. L. (2019). Lichens as indicators of environmental quality in
southern Brazil: An integrative approach based on community composition and
functional parameters. Ecological Indicators, 107, 105587.
Lücking, R.
(1999). Foliicolous lichens and their lichenicolous fungi from Ecuador, with a
comparison of lowland and montane rain forest. Willdenowia, 29(1/2),
299-335.
Lücking, R.,
Moncada, B., Martínez-Habibe, M. C., Salgado-Negret, B. E., Celis, M.,
Rojas-Zamora, O., ... & Borsch, T. (2019). Lichen diversity in colombian caribbean
dry forest remnants. Caldasia, 41(1), 194-214.
Luna-Florin, A.
D., Nole-Nole, D. A., Rodríguez-Caballero, E., Molina-Pardo, J. L., &
Giménez-Luque, E. (2022 a). Ecological Characterization of the Flora in
Reserva Ecológica Arenillas, Ecuador. Applied Sciences, 12(17),
8656.
Miles, L.,
Newton, A. C., DeFries, R. S., Ravilious, C., May, I., Blyth, S., ... &
Gordon, J. E. (2006). A global overview of the conservation status of tropical
dry forests. Journal of biogeography, 33(3), 491-505.
Miranda‐González,
R., & McCune, B. (2020). The weight of the crust: Biomass of crustose
lichens in tropical dry forest represents more than half of foliar biomass. Biotropica, 52(6),
1298-1308.
Moreira, N. M.,
Chacón, N. V., Flor, J. P., Tamayo, J. L., & de María Valverde, F. (2016).
Composición Florística y Nuevos Registros para la Reserva Ecológica Arenillas,
El Oro-Ecuador. Investigatio, (8), 111-132.
Nash, IIITH.
Ryan, B. D., Gries, C., Bungartz, F. (2002) Lichen flora of the greater Sonoran
Desert region, vol 1. Lichens Unlimited, Tempe.
Nash, IIITH.,
Gries, C., & Bungartz, F. (2007). Lichen flora of the greater Sonoran
Desert region, vol 3. Lichens Unlimited, Tempe.
Nash, IIITH.,
Ryan, B.D., Diederich, P., Gries, C., Bungartz, F. (2004). Lichen flora of the
Greater Sonoran Desert region, vol 2. Tempe, Lichen Unlimited.
Nirhamo, A.,
Hämäläinen, A., Hämäläinen, K., & Kouki, J. (2024). The response of epiphytic
lichens on living and dead Pinus sylvestris to prescribed fires of varying
severity. Forest Ecology and Management, 551, 121558.
Rosabal, D.,
& Aragón, G. (2010). Líquenes epífitos en el matorral costero de la
Reserva Ecológica Siboney-Juticí (Cuba). Botanica
Complutensis, 34, 21.
Tapia-Armijos,
M. F., Homeier, J., Espinosa, C. I., Leuschner, C., & De La Cruz, M.
(2015). Deforestation and forest fragmentation in South Ecuador since the
1970s–losing a hotspot of biodiversity. PloS one, 10(9),
e0133701.
Vergara-Torres,
C. A., Pacheco-Álvarez, M. C., & Flores-Palacios, A. (2010). Host preference
and host limitation of vascular epiphytes in a tropical dry forest of central
Mexico. Journal of Tropical Ecology, 26(6), 563-570.
Weerakoon, G.,
Wolseley, P., Will-Wolf, S., & Wijeyaratne, C. (2020). Corticolous lichen
species as indicators of disturbed/undisturbed vegetation types in the central
mountains of Sri Lanka. The Lichenologist, 52(3), 233-245.
Werner, F. A.,
& Gradstein, S. R. (2009). Diversity of dry forest epiphytes along a
gradient of human disturbance in the tropical Andes. Journal of
vegetation science, 20(1), 59-68.
Wolseley, P.
A., & Aguirre‐Hudson, B. (1997). Fire in tropical dry forests:
corticolous lichens as indicators of recent ecological changes in Thailand. Journal
of biogeography, 24(3), 345-362.