 |
INTRODUCCIÓN
Tasas de respiración de variedades de Vaccinium corymbosum L. y tecnologías postcosecha: Una revisión sistemática
Respiration rates of Vaccinium corymbosum L. varieties and postharvest technologies: A systematic review
Luis Pasco1; Janet Gonzales2
1 Facultad de Ciencias Agropecuarias, Universidad Nacional de Trujillo. Ciudad Universitaria, La Libertad, Perú.
* Autor corresponsal: t512901420@unitru.edu.pe (L. Pasco).
ORCID de los autores:
L. Pasco: https://orcid.org/0009-0005-5149-7410 J. Gonzales: https://orcid.org/0000-0002-4207-1320
RESUMEN
Conocer las tasas de respiración en arándanos es fundamental porque determinan la velocidad del metabolismo, la vida postcosecha y la susceptibilidad al deterioro, influyendo directamente en firmeza, pérdidas fisiológicas y desarrollo de patógenos. El presente artículo tuvo como objetivo compilar las tasas de respiración de variedades de Vaccinium corymbosum L., identificar los factores abióticos que las modifican y describir las principales tecnologías postcosecha relacionadas. Se aplicó la metodología PRISMA 2020, obteniéndose 86 artículos científicos publicados entre 2020 y 2025 que cuantificaron tasas respiratorias y evaluaron tecnologías como atmósferas modificadas, ozono, quitosano y radiación UV-C. Los resultados mostraron que las variedades analizadas presentan tasas entre 4,1 y 77 mg CO₂ kg⁻¹ h⁻¹, determinadas principalmente por la temperatura y el genotipo. Las tecnologías evaluadas demostraron eficacia directa o indirecta para disminuir la tasa respiratoria, ya sea reduciendo o inhibiendo Botrytis cinerea, manteniendo la firmeza o incrementando antocianinas y fenoles totales. Se concluye que humedades relativas de 90% – 95%, concentraciones de CO₂ inferiores al 20% y O₂ por debajo del 10% son factores determinantes que condicionan la tasa de respiración, la vida postcosecha y la calidad final del fruto.
Palabras clave: Tasas respiratorias; Vaccinium corymbosum L.; Variedades de arándanos; Postcosecha; tecnologías postcosecha.
ABSTRACT
Understanding respiration rates in blueberries is essential because they determine metabolic activity, postharvest life, and susceptibility to deterioration, directly influencing firmness, physiological losses, and pathogen development. This article aimed to compile the respiration rates of Vaccinium corymbosum L. varieties, identify the abiotic factors that modify them, and describe the main related postharvest technologies. The PRISMA 2020 methodology was applied, resulting in 86 scientific articles published between 2020 and 2025 that quantified respiratory rates and evaluated technologies such as modified atmospheres, ozone, chitosan, and UV-C radiation. Results showed that the analyzed varieties present respiration rates ranging from 4.1 to 77 mg CO₂ kg⁻¹ h⁻¹, mainly determined by temperature and genotype. The evaluated technologies demonstrated direct or indirect effectiveness in decreasing respiratory rate, either by reducing or inhibiting Botrytis cinerea, maintaining firmness, or increasing anthocyanins and total phenols. It is concluded that relative humidities of 90% – 95%, CO₂ concentrations below 20%, and O₂ concentrations below 10% are key abiotic factors that condition respiration rate, postharvest life, and final fruit quality.
Keywords: Respiratory rates; Vaccinium corymbosum L.; Blueberry varieties; Postharvest; postharvest technologies.
Recibido: 07-07-2025.
Aceptado: 03-12-2025.
El arándano es un fruto cada vez más valorado en el mercado global debido a sus destacados atributos nutricionales y funcionales. Posee un perfil rico en vitaminas, fibra dietética y compuestos fenólicos como antocianinas y flavonoides (Tobar et al., 2021; Azari et al., 2022; Duan et al., 2022; Wei et al., 2023; Sun et al., 2022). Estos pigmentos le confieren su característico color azul y un elevado potencial antioxidante, ligado a beneficios para la salud humana, actividad anticancerígena, cardioprotector y antiinflama-toria (Stull et al., 2024; Silva et al., 2020). Su sabor agradable y el creciente reconocimiento de sus propiedades funcionales han impulsado la demanda de arándanos frescos a nivel mundial. Sin embargo, estas ventajas saludables y organolépticas conllevan desafíos postcosecha: el fruto del arándano tiene una piel muy fina y un alto contenido de agua que lo hace frágil y permeable, sumado a su metabolismo acelerado lo hace extremadamente perecedero (Xing et al., 2021; Liu et al., 2023). De hecho, sin conservación adecuada, la vida útil del arándano en fresco es muy corta lo que dificulta su comercialización a larga distancia.
El problema postcosecha radica en que el arándano mantiene una alta tasa respiratoria, por lo cual acelera su deterioro metabólico (Falagán et al., 2020). Este consumo continuo de oxígeno y producción de CO₂ acelera la senescencia, provocando pérdida de firmeza, marchitamiento y decoloración del fruto. Simultáneamente, al no contar con una cutícula protectora gruesa, el fruto es muy susceptible a la infección por hongos fitopatógenos como Botrytis y Penicillium que liberan enzimas hidrolíticas y provocan pudriciones postcosecha (Wu et al., 2022). Estos procesos fisiológicos y microbiológicos resultan en una rápida degradación de la calidad organoléptica de textura, aroma y color; pero también nutricionalmente reduciendo el contenido de antocianinas y fenoles del arándano, con cuantiosas pérdidas económicas para la industria y los productores.
Para enfrentar estas limitaciones, se han evaluado numerosas tecnologías postcosecha centradas en reducir la respiración, senescencia del fruto y en controlar la proliferación microbiana. Entre ellas destacan las atmósferas modificadas (CA/MAP) y el enriquecimiento con CO₂, el ozono gaseoso, recubrimientos comestibles a base de quitosano con nanopartículas o aceites esenciales; radiaciones ultravioletas, irradiación gamma y otras. En la práctica, estas técnicas buscan crear entornos poco propicios para el metabolismo acelerado y la actividad patógena. Por ejemplo, Falagán et al. (2020) aplicaron una atmósfera controlada graduada en arándanos ‘Duke’ y observaron que la tasa respiratoria basal disminuyó significativamente, prolongando la vida útil del fruto hasta en un 25% en comparación con el control. De forma complementaria, Smrke et al. (2021) encontraron que almacenar frutos en condiciones de CO₂ moderado (5%) y 5% O₂ ayudaba a mantener los compuestos fenólicos y antocianinas, mientras que atmósferas con CO₂ muy elevadas (≥15%) aceleraban su degradación. Estos resultados confirman que las CA bien dosificadas retardan el metabolismo respiratorio y la senescencia, preservando mejor la calidad nutricional del arándano.
De igual modo, el ozono gaseoso ha recibido atención por su capacidad antimicrobiana y antioxidante. Wu et al. (2022) reportaron que la fumigación con ozono inhibe el crecimiento de Penicillium en los arándanos almacenados, conservando la firmeza del fruto y atenuando la pérdida de sólidos solubles, fenoles totales y antocianinas. El ozono actúa oxidando los hongos patógenos y, al mismo tiempo, puede activar defensas antioxidantes en el fruto. En línea con esto, Gorzelnay et al. (2024) observaron que la aplicación de ozono tras la cosecha incrementó en 10% el contenido de compuestos fenólicos totales y mejoró hasta en 15% – 22% la capacidad antioxidante de arándanos almacenados. Estos estudios indican que el ozono reduce la carga microbiana y ayuda a mantener intactos los antioxidantes de los frutos.
Los recubrimientos comestibles basados en quitosano (CTS) también han demostrado eficacia para prolongar la vida útil del arándano. Xing et al. (2021) mostraron que un recubrimiento de quitosano enriquecido con nanopartículas de TiO₂ ralentizaba la caída de la firmeza y el contenido de vitamina C, así como la degradación de antocianinas y compuestos fenólicos totales durante 28 días a 0 °C. De manera similar, Sun et al. (2025) demostraron que una película de quitosano con aceite esencial de tomillo reducía significativamente la pérdida de peso de arándanos almacenados, al tiempo que impedía la disminución de antocianinas y vitamina C y enlentecía el incremento de malondialdehído (MDA). Otras formulaciones como recubrimientos con cineol o cinamaldehído han mostrado actividad antifúngica, preservando el contenido de fenoles antioxidantes y retrasando el ablandamiento de los frutos. En conjunto, estos tratamientos físicos y de recubrimiento controlan patógenos y contribuyen a mantener la integridad nutricional (fenoles, antioxidantes) del fruto (Xu et al., 2023).
Además, se han explorado radiaciones lumínicas como estrategia no química. La radiación UV-C postcosecha es conocida por destruir ADN microbiano; Wang et al. (2022) reportaron que la aplicación de UV-C a los arándanos retrasó la senescencia y elevó la actividad antioxidante del fruto. Paralelamente, tratamientos de luz visible en longitudes específicas pueden inducir rutas metabólicas de defensa en el fruto. Wei et al. (2023) observaron que la luz azul incrementó la expresión de genes clave de la biosíntesis de antocianinas y aumentó el contenido de estos pigmentos en arándanos, reforzando su capacidad antioxidante. De forma análoga, Liu et al. (2025) informan que irradiaciones postcosecha con luz UV-A y luz azul potenciaron la acumulación de antocianinas aciladas en frutos de arándano, sugiriendo un papel regulador de estas longitudes de onda en las vías biosintéticas. Aunque la irradiación gamma de bajo dosis ha sido utilizada para desinfectar hortalizas, en arándanos estudios recientes indican que dosis moderadas pueden inhibir microorganismos y extender la vida en anaquel.
A pesar de estos avances, los estudios suelen evaluar las tecnologías de forma aislada o en combinaciones específicas, sin ofrecer un panorama integrado de su eficacia relativa. Dado que las pérdidas postcosecha del arándano pueden superar el 20% - 30% en condiciones comerciales, es imprescindible evaluar de manera sistemática y comparativa estas tecnologías individuales y combinadas para optimizar su aplicación en la cadena de frío. Comprender cómo se superponen o potencian sus efectos, por ejemplo, combinar recubrimientos con atmósferas modifi-cadas o radiaciones germicidas podría revelar siner-gias útiles para minimizar el deterioro. En este contexto, se requiere una síntesis exhaustiva de la literatura reciente que integre resultados sobre las tasas respiratorias del arándano y las tecnologías postcosecha aplicadas.
El objetivo general de este estudio fue conocer las tasas de respiración de diversas variedades de Vaccinium corymbosum L., identificando los factores abióticos que la afectan y describir las diversas tecnologías que se emplean a nivel postcosecha.
METODOLOGÍA
Revisión sistemática con enfoque cualitativo, guiándose de recomendaciones PRISMA (Referred Items for Systematic Reviews and Meta-Analyses) 2020 (Figura 1). Se recopilaron 240 artículos abarcando el periodo 2020 al 2025, considerando que mínimamente el 50% deben estar redactados en inglés y el porcentaje restante en otros idiomas.
Se escudriño en las bases de datos de ScienceDirect, MDPI, Frontiers, Google Académico, Springer-Nature, Taylor & Francis, Wiley Online Library, SSRN, SCI, Latindex, Scielo, ChemSpider y Oxford Academic, utilizando términos como Respiratory rates, Vaccinium corymbosum L., Blueberry varieties, Postharvest, postharvest technologies.
El proceso de cribado se seleccionaron los artículos de revisión y artículos de investigación que perte-nezcan a una revista científica, posteriormente se utilizaron ecuaciones boleanas combinando tér-minos como “Vaccinium corymbosum”, “tasa de respiración” y “tecnología postcosecha” no aplicando restricciones idiomáticas. La principal ecua-ción fue: (“Vaccinium corymbosum” OR “blue-berry”) AND (“respiration rate” OR “respiratory metabolism”) AND (“postharvest” OR “postharvest technology”).
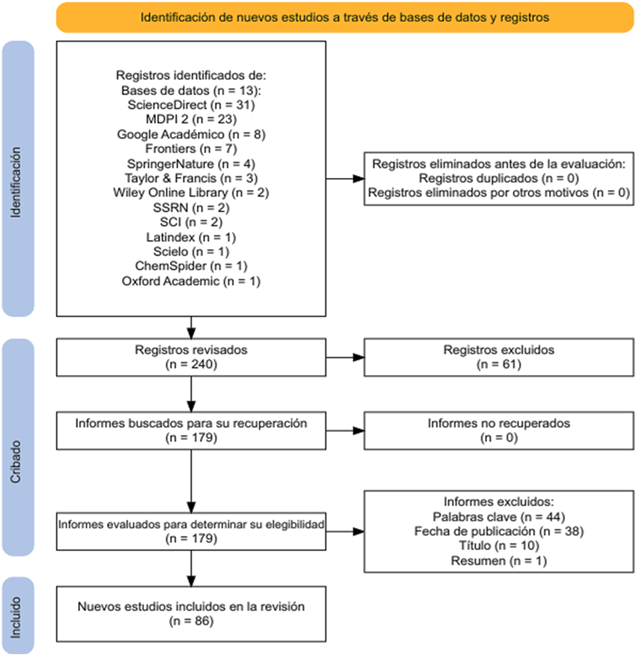
Figura 1. Identificación de nuevos estudios a través de base de datos y registros. Nota. El diagrama Prisma representa la metodología de cribado, obteniendo 86 estudios finales. Tomado de Haddaway et al. (2022).
Para las tecnologías específicas se utilizaron combi-naciones como: (“modified atmosphere packaging” OR MAP), (“chitosan coating”), (“UV-C” OR “ultraviolet-C”) y (“ozone” OR “O3”), cada una emparejada con “blueberry” y términos de postco-secha y respiración.
No se incluyeron artículos que no estuvieran dispo-nibles, que carecieran de una estructura de inves-tigación científica y que no contengan las variables de estudio deseadas. De los 240 artículos mediante la metodología de cribado se obtuvieron 86 artículos finales, de los cuales pertenecen 31 a ScienceDirect, 23 a MDPI, 8 a Google Académico, 7 a Frontiers, 4 a SpringerNature, 3 a Taylor & Francis, 2 Wiley Online Library, 2 a SSRN, 2 a SCI, 1 a Latindex, 1 a Scielo, 1 a ChemSpider y 1 a Oxford Academic.
RESULTADOS Y DISCUSIÓN
1. Factores abióticos
La respiración de la fruta es un conjunto de reacciones metabólicas aerobias en el que se consumen O₂ y se liberan CO₂, determinando la velocidad metabólica, maduración, firmeza y la vida en anaquel de la baya. Entre los factores abióticos que modulan la tasa respiratoria se encuentra la temperatura, siendo el factor principal, humedad relativa, O₂ y CO₂ (Figura 2).
Según la Figura 2, valores superiores de 20 °C elevan la tasa respiratoria, la humedad relativa inferior a 90% y superior a 95% puede provocar un incremento en el deterioro causado por el desarrollo fúngico; y finalmente, altas concentraciones de gases en MAP/CA de O₂ y CO₂ pueden generar una reducción de la vida postcosecha al inducir daños o sabores fermentativos (Rivera et al., 2022; Fang y Wakisaka, 2021; Czerwinski et al., 2021).
1.1. Temperatura
La temperatura es uno de los factores más críticos en la conservación de los arándanos, ya que influye directamente en la tasa respiratoria y, por ende, en su vida útil. El grupo de los berries son altamente sensibles a las fluctuaciones de temperatura, lo que puede acelerar su metabolismo y degradación. Se ha visto que almacenar arándanos a 0 °C reduce su tasa respiratoria en un 50% en comparación con almacenarlos a 20 °C, pero esto va a variar según la variedad (Varela et al., 2022). Aunque las diferencias de una temperatura a otra sean mínimas (0 - 5 °C), de igual forma pueden tener un impacto significativo en su conservación. De acuerdo con Li et al. (2024) encontró que mantener una temperatura constante de 2 °C reduce la tasa respiratoria en un 35% en comparación con 5 °C, lo que se traduce en una mayor retención de firmeza y contenido de azúcares.
Además, la temperatura no solo afecta la tasa respi-ratoria, también la susceptibilidad a enfermedades fúngicas. Por ejemplo, un estudio de Wang et al. (2021) demostró que almacenar arándanos a 0 °C reduce la incidencia de Botrytis cinerea (moho gris) en un 60% en comparación con 5 °C. Esto se debe a que las bajas temperaturas inhiben la germinación de esporas y el crecimiento micelial. Es importante evitar temperaturas demasiado bajas, ya que pueden causar daño por frío, especialmente en variedades sensibles (Hao et al., 2019; Millas et al., 2022).
Las tasas de respiración fueron medidas de bayas en color azul al 100% o “ripe”, abarcando los rangos en donde está la media de los arándanos (Tabla 1). Se muestra una clara tendencia de disminución en la tasa de respiración del arándano a medida que la tempe-ratura desciende. Esta reducción se observa en todas las variedades analizadas, lo que concuerda con la teoría metabólica de que la actividad enzimática y la velocidad de las reacciones bioquímicas disminuyen con temperaturas más bajas (Anaya et al., 2020; Brizzolara et al., 2020; Ramos et al., 2024; Varela et al., 2022). A 20 °C, las tasas de respiración son significativamente más altas en comparación con las registradas a 5 °C y 0 °C. Por ejemplo, la variedad Snowchaser presenta una tasa de 39,6 ± 0,5 a 20 °C, mientras que a 5 °C disminuye a 10,0 - 14,3 y a 0 °C baja aún más a 5,9 - 8,4. Esta misma tendencia se observa en otras variedades como Emerald y Primadonna, lo que sugiere que la reducción de temperatura ralentiza el metabolismo respiratorio de los frutos (Brizzolara et al., 2020).

Figura 2. Factores abióticos que influyen en la tasa de respiración de Vaccinium corymbosum. Nota. Los valores de CO₂ se expresan en porcentaje (% v/v) o en kilopascales (kPa), los niveles de O₂ en porcentajes en atmósferas modificadas o controladas. La temperatura (°C), humedad relativa (HR) en porcentaje (%). “↑” indica incremento de la tasa de respiración y aceleración de la maduración, mientras que “<” indica valores menores a, > es valores superiores.
Tabla 1
Tasas de respiración en Vaccinium corymbosum influenciado por las temperaturas
|
Variedades |
Temperatura |
||||
|
20 °C |
15 °C |
5 °C |
0 °C |
||
|
Misty |
38,4 - 45,0 |
||||
|
Powderblue |
|
48-50 |
|||
|
Premier |
|
49-66 |
|||
|
Miss Jackie |
|
42 |
|||
|
Miss Lilly |
|
48-67 |
|||
|
Suziblue |
32,8 ± 1,7 |
75 |
|||
|
Emerald |
28,5 - 26,6 |
47-69 |
32-43 |
10,0-14,8 |
5,5-7,9 |
|
Snowchaser |
39,6 ± 0,5 |
45-61 |
31-39 |
10,0-14,3 |
5,9-8,4 |
|
Farthing |
|
40-55 |
28-37 |
8,5-12,0 |
5-7,3 |
|
San Joaquin |
|
52-73 |
35-45 |
10,1-14,7 |
5.9-8,3 |
|
Kestrel |
|
59-77 |
38-50 |
10,5-16,6 |
6,3-10,2 |
|
Abundance |
|
42-57 |
31-40 |
7,9-13,2 |
4,1-8.8 |
|
Primadona |
|
56-74 |
40-50 |
10,0-14,0 |
6,1-7,7 |
|
Ventura |
|
44-61 |
26-35 |
8,2-11,4 |
4,9-7,5 |
|
Springhigh |
|
66-76 |
44-56 |
10,8-11,9 |
6,7-7,0 |
|
Scintilla |
|
45-58 |
31-38 |
9,0-13,0 |
6.0-8,3 |
Nota. Los datos de esta tabla están expresados en mg CO2/Kg.h. Los datos de celdas rojas fueron extraídos de Wang et al. (2022), amarrilla de Varela et al. (2022) y celdas verdes datos extraídos y adaptados de Lare et al. (2023).
Sin embargo, es importante notar que la magnitud de la reducción de la tasa de respiración varía entre variedades. Por ejemplo, Kestrel tiene una tasa de 59 - 77 a 20 °C y baja a 10,5 - 16,6 a 5 °C y 6,3 - 10,2 a 0 °C, lo que indica que algunas variedades pueden ser más sensibles a la disminución de temperatura que otras. Esta variabilidad puede estar relacionada con la variabilidad genética de la variedad por diferencias en la composición celular, ya sea por variaciones en el grosor de la pared celular y proporción del espacio intracelular pueden alterar la difusión de O2/CO2, distinta termotolerancia enzimática principalmente por la actividad de 2,4-diclorofenol-resorufina (deshidrogenasa) y valores de coeficiente Q10 (Farneti et al., 2025).
El comportamiento respiratorio de las diferentes variedades de arándano varía considerablemente según la temperatura, lo que refleja la influencia del genotipo en la actividad metabólica del fruto. Se observa que las tasas de respiración tienden a ser más elevadas a temperaturas altas, mientras que disminuyen progresivamente a medida que la temperatura desciende. Esta diferencia en la tasa de respiración tiene una mejor distinción si se comparan tasas de 20 °C a 5 °C y tampoco existen grandes diferencias de 5 a 0 °C (Figura 3). Es importante resaltar que se necesitan las tasas de respiración de arándano de las diferentes variedades en temperaturas de 10 °C y 25 °C para cuantificar los valores Q10, el cual nos indica cuanto cambia la tasa respiración en dos valores que difieren en 10 °C, esto muestra si la fruta es muy sensible al calor con Q10 de 2 o 3 o con poca sensibilidad con valores cercanos al 1, esto se ve reflejado en la vida útil de la fruta (Brizzolara et al., 2020). Entre todas las variedades evaluadas, Miss Lilly se destaca como la que presenta la mayor tasa de respiración, alcanzando un valor de 75 mg CO₂/kg·h a 20 °C. Le sigue de cerca Springhigh, con una tasa de 71 mg CO₂/kg·h en la misma condición. Estas cifras sugieren que estas variedades tienen una alta actividad de la deshidrogenasa, por ende, una mayor susceptibilidad al deterioro postcosecha si no se manejan adecuadamente.
Por otro lado, Ventura se posiciona como la variedad con la menor tasa de respiración en temperaturas bajas, con valores de 9,8 mg CO₂/kg·h a 5 °C y 6,2 mg CO₂/kg·h a 0 °C. Esto indica que su metabolismo se ralentiza de manera más eficiente en frío teniendo un coeficiente de temperatura Q10, lo que podría contribuir a una mejor conservación durante el almacenamiento. En cuanto a temperaturas más elevadas, Emerald destaca por ser una de las variedades con menor tasa de respiración a 20 °C, registrando 27,55 mg CO₂/kg·h.
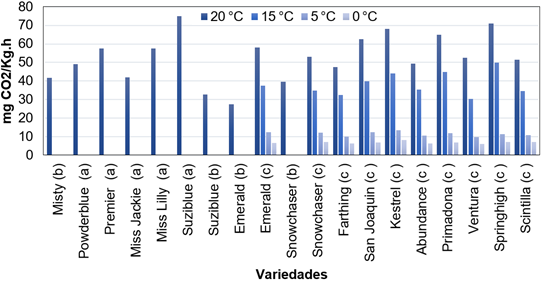
Figura 3. Tasas de respiración media en variedades de arándano influenciadas por temperaturas. Nota. Las medias obtenidas fueron extraídas de (a) Wang et al. (2022); (b) de Lare et al. (2023); (c) Varela et al. (2022).
La tendencia general muestra que, conforme la temperatura desciende, la respiración de todas las variedades disminuye significativamente. A 5 °C y 0 °C, donde la actividad metabólica se reduce drásti-camente, Ventura y Snowchaser son las variedades con los valores más bajos. Esto sugiere que podrían ser más adecuadas para almacenamiento en frío prolongado.
Las diferencias observadas en los datos reportados por Wang et al. (2022), Lare et al. (2023) y Varela et al. (2022) también pueden deberse a múltiples factores, como ligeras diferencias en el grado de madurez del fruto al momento de la medición; tipo de maquinaria e intervalo o incluso las condiciones específicas de cada experimento (Brondino et al., 2022; Cai et al., 2021; Rivera et al., 2022).
El hecho de que la tasa de respiración disminuya con la temperatura tiene implicaciones prácticas importantes para la postcosecha del arándano. La reducción de la actividad metabólica a temperaturas más bajas contribuye a retardar la maduración, deterioro del fruto, menor pérdida de peso prolongando su vida útil y manteniendo su calidad por más tiempo sin comprometer los compuestos fenólicos, esto también impide que las perdidas postcosecha sean tan elevadas (Falagán et al., 2020; Smrke et al., 2021; Yan et al., 2020). En este sentido, la refrigeración se presenta como una estrategia clave para la conservación de los arándanos durante el almacenamiento y el transporte.
1.2. Humedad relativa
Otro elemento importante en la conservación de los arándanos es la humedad relativa (HR), esté puede comprometer en gran forma la firmeza y la pérdida de agua en la fruta. Si la concentración es la adecuada puede reducir la tasa de respiración y evitar el ablandamiento.
Se ha demostrado que el arándano prospera a una HR del 90% - 95%, que reduce la tasa respiratoria en aproximadamente un 30% en comparación con niveles de humedad más bajos (Anthony et al., 2024; Pratap et al., 2023; Ramos et al., 2024a); sin embargo, puede ser difícil mantener una HR alta porque puede favorecer el crecimiento de hongos como Alternaria spp. y Botrytis cinerea (Rhodes et al., 2024).
El envasado con control de humedad es una solución que se estudia para aumentar la vida en berries. Por ejemplo, un estudio de Zhang et al. (2020) demostró que usando películas de polietileno microperforadas en frutos de Vaccinium corymbosum L. preservan la HR dentro del envase y reduce la pérdida de agua en un 40%. Además, estas películas permiten un intercambio de gases suficiente, lo que ayuda a regular la tasa de respiración. El uso de recubrimientos a base de quitosano, que tiene cualidades antifúngicas y reguladoras de la HR, es otra nueva tecnología (Liu et al., 2021).
1.3. Dióxido de carbono
Las frutas y verduras, especialmente Vaccinium corymbosum L., se han conservado utilizando dióxido de carbono (CO2) por su capacidad para ralentizar la respiración y retrasar la maduración. Según investigaciones recientes, concentraciones de CO2 entre el 5% puede alargar la vida útil de los arándanos al disminuir su tasa respiratoria manteniendo peso y calidad nutricional en 62 días de almacenamiento; concentraciones superiores al 20% pueden causar daños en el fruto, incluyendo oscurecimiento de la piel y pérdida de firmeza (Smrke et al., 2021; Moggia & Lobos, 2023). En los cultivares Duke (Highbush) y Ochlockonee (ojo de conejo) concentraciones de CO2 de 15% (15KPa) y 20% (20KPa) en conjunto con temperaturas de 1°C por tres días reducen la pudrición y mejoran la firmeza del fruto (Toledo et al., 2024). Esto implica que, dado que los tipos de arándanos varían según el genotipo en términos de comportamiento y resultados post-almacenamiento, las concentraciones de CO2 deben modificarse para ellos.
Forney et al. (2022) afirman que los efectos a diferentes concentraciones de CO2 pueden variar en función del cultivar. Por ejemplo, entre los cuatro cultivares estudiados (Duke, Aurora, Brigitta, Jersey y Liberty), se observó una disminución de la descomposición a 20KPa de CO2 (20%), con un aumento de azúcares y ácidos a medida que aumentaba la concentración. Sin embargo, también existe una relación inversa, ya que cuanto mayor es la concentración de CO2, menos firme es la fruta, y a medida que aumentan las concentraciones, también aumentan los volátiles fermentativos como el etanal, el acetaldehído y el acetato de etilo, lo que modifica el sabor de la fruta tras el almacenamiento. Se descubrió que Aurora tenía menos decoloración de la pulpa y que el cultivar Liberty producía menos sustancias químicas fermentativas volátiles (Forney et al., 2022).
2. Tecnologías
Según Chen et al. (2024), asegura que entre las tecnologías empleadas a nivel postcosecha en frutas y verduras están bajas temperaturas, envasado en atmosferas modificadas o Modified Atmosphere Packaging (MAP), plasma frio o Cold Plasma (CP), luz pulsada o Pulsed Light (PL), ultrasonido, luz ultravioleta, y ozono. En esta revisión se abordará netamente MAP, además se consideró agregar quitosano, radiación y ozono.
2.1. Envasado en Atmósferas Modificadas
Las técnicas de MAP consisten en modificar la composición gaseosa dentro de un envase para prolongar la vida útil y preservar la calidad de los alimentos frescos ralentizando las reacciones de deterioro (Czerwiński et al., 2021; Fang & Wakisaka et al., 2021; Pinto et al., 2020).
La reducción de la tasa de respiración provocada por MAP (Figura 4) se debe a la disminución de los niveles de oxígeno y aumento en la concentración de dióxido de carbono en atmosferas controladas, lo cual permite una rápida difusión de gases sostenido por bajos niveles de O2 en periodos prolongados (Anaya et al., 2020).
El mantenimiento de la firmeza de la fruta es causado por el bajo metabolismo respiratorio y al decremento en la actividad de enzimas pectolíticas (pectin metil esterasa y poligalacturonasa), causantes de deterioro de la pared celular (Yan et a., 2020; Liu et al., 2024). Al reducir este deterioro, la descomposición del fruto se ralentiza, atenuando el crecimiento micelar de hongos como Botrytis cinerea (Ramos et al., 2021).

Figura 4. Efectos del envasado en atmosferas modificadas en frutos de Vacinium corymbosum. Nota. TR = Tasa de Respiración; AS = Ácido ascórbico.
Debido a la desaceleración de los procesos metabo-licos, en arándanos, como en la variedad ‘Duke’, estas atmósferas mantienen significa-tivamente los niveles de vitamina C (AS) respecto al grupo control. Asimismo, limitan la degradación de flavonoides, antocianinas y polifenoles al disminuir la exposición al oxígeno y estabilizar los pigmentos (Almasoud et al., 2024; Brizzolara et al., 2020; Kowalczy et al., 2025).
Los tratamientos MAP en arándanos han demos-trado ser efectivos para mantener la calidad microbiológica, nutricional y sensorial de estos frutos durante el almacenamiento en frío (Pinto et al., 2020; Kowalczyk et al., 2025). Algunos de los estudios han evaluado el efecto de diferentes condiciones de MAP, como la combinación de atmósfera controlada (AC) y MAP, en la conser-vación de los compuestos bioactivos y la actividad antioxidante de los arándanos (Kowalczyk et al., 2025).
Además, se han probado otras tecnologías comple-mentarias al MAP, como el uso de recubrimientos biodegradables, el tratamiento con ozono y la irradiación UV, para mejorar aún más la conservación de los arándanos (Jaramillo et al., 2021; Romero et al., 2022; Hu et al., 2021).
Una tecnología emergente en este ámbito es el uso de atmósferas controladas dinámicas (ACD), que ajustan automáticamente los niveles de CO2 y O2 en función de las necesidades del fruto. Un estudio demostró que el uso de ACD con niveles de 0,0 – 20,0 kPa CO2 y 10,0 kPa O2 reduce la tasa respiratoria y prolonga la vida útil de los arándanos (Forney et al., 2022). Además, esta tecnología es más sostenible que los métodos tradicionales, ya que reduce el desperdicio de fruta y el uso de productos químicos.
2.2. Quitosano
El quitosano, un biopolímero versátil, se obtiene mediante la N-desacetilación parcial de la quitina, la principal fuente de obtención son los exoesqueletos de crustáceos, pero también se encuentra en insectos y hongos (Liao et al., 2022; Pellis et al., 2022). Su proceso de obtención implica etapas de desmine-ralización, desproteinización y desacetilación, resul-tando en un polímero cuyas propiedades funcionales varían según su grado de desacetilación y la fuente (Rasweefali et al., 2022; Hahn et al., 2020; Izadi et al., 2025).
Propiedades del quitosano a nivel postcosecha en frutas y verduras:
1. Antimicrobiano: Los grupos amino protonados interactúan con las membranas celulares micro-bianas, disrumpiendo su integridad (Yan et al., 2021; Wang et al., 2020). Del mismo modo esta propiedad se puede potenciar cuando simultáneamente se combina con aceites esenciales, añadiendo más efectos en el tratamiento.
2. Barrera física: Debido a la formación de recubrimientos semipermeables elástica y resisten en la fruta puede formar una atmósfera interna que controla de mejor forma intercambio gaseoso y la pérdida de agua del epicarpio, siendo una barrera extra que se le da a la fruta a parte del blooming (Dai et al., 2025; Munira et al., 2024; Sun et al., 2025).
3. Mejora de la capacidad antioxidante e inducción de defensas: Su acción en suma con otras formas de conservación mejora la capacidad antioxidante de frutos de arándano, del mismo modo estimula los mecanismos de defensa en los tejidos vegetales, mejorando su respuesta ante patógenos y comportándose de forma superior al estrés oxidativo en el almacenamiento (Dai et al., 2025; Tan et al., 2025; Torres et al., 2025).
4. Biodegradabilidad Su capacidad de degradarse con el tiempo y de formar una película imperceptible la convierten en una gran opción para aumentar la vida útil de los frutos (Sun et al., 2025; Yang et al., 2025).
5. Hidratante: Debido a la formación de barrera, permite una mejor retención de humedad en la fruta, evitando la degradación de la calidad por la afinidad que posee con el agua por sus grupos hidroxilos y aminoácidos (Chaiwong et al., 2020; Wang et al., 2024).
Los recubrimientos basados en quitosano han emergido como una solución altamente efectiva para retrasar la descomposición, pérdida de peso del fruto, reducir el crecimiento de hongos y mohos; también manteniendo la firmeza (Figura 5), el contenido fenólico total (TPC), capacidad antioxidante (AC), solidos solubles totales (TSS), acidez titulable (TA), acido ascórbico o vitamina C (AsA), pectina soluble en agua (WSP) y pectina soluble en soluciones salinas (ISP). Algunas asociaciones de recubrimientos actúan disminuyendo la actividad de enzimas favorecen a la descomposición de la fruta como la polifenol-oxidasa (PPO) y peroxidasa (POD) (Tabla 2) (Ramos-Bell et al., 2022a; Ramos-Bell et al., 2022b; Xu et al., 2023; Xing et al., 2021; Sun et al., 2022; Lee et al., 2024; Eldib et al., 2020; Sun et al., 2025).
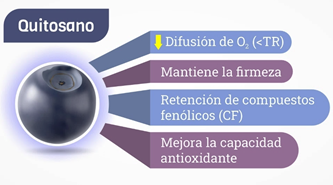
Figura 5. Efectos del recubrimiento de quitosano en frutos de Vacinium corymbosum. Nota. TR = Tasa de Respiración; AS = Ácido ascórbico.
Los recubrimientos postcosecha actúan al disminuir la difusión de oxígeno e impidiendo la salida de dióxido de carbono, se genera una atmósfera modificada de forma pasiva (bajos niveles de O₂ y altos de CO₂) en el interior del fruto (Sharma et al., 2024; Dai et al., 2025). Esta tecnología ralentiza la actividad metabólica, manteniendo la firmeza durante decenas de días y preservan el contenido de sólidos solubles, siendo un indicativo de un menor consumo respiratorio por consecuente mayor vida útil del producto, pero la tasa de respiración afecta de forma indirecta (no cuantificada en los estudios) por la ralentización de la actividad enzimática (Xing et al., 2021; Sun et al., 2022; Lee et al., 2024). De manera complementaria, muchos recubrimientos incorporan compuestos bioactivos de aceites esenciales o aditivos como eugenol, β-cariofileno y ácido salicílico que interfieren directamente con las enzimas del metabolismo respiratorio (citocromo oxidasa y complejos de la cadena de transporte electrónico) y modulan la actividad de enzimas antioxidantes como la peroxidasa (POD) y la polifenoloxidasa (PPO) (Almasoud et al., 2024; Chen et al., 2022; Xing et al., 2021; Sun et al., 2025).
Tabla 2
Efecto de tratamientos de quitosano asociado a tecnologías postcosecha en Vaccinium spp.
|
Tratamiento |
Composición |
Condiciones |
Efecto |
Referencia |
|
Quitosano + Ácido salicílico (AS) (in vitro) |
0,5-1,5% quitosano (90% desacetilación) + 2-5 mM ácido salicílico |
25 °C, 90-95% HR por 10 días |
↓ Inhibición de 93% el crecimiento micelial. ↓ 90% de la esporulación. |
Ramos-Bell et al., 2022a |
|
Quitosano + Ácido salicílico (in vivo) |
1,5% quitosano + 5 mM ácido salicílico |
Inmersión 2 min, 25°C, 90-95% HR por 10 días |
↓ 60% en la incidencia de B. cinerea. |
Ramos-Bell et al., 2022b |
|
CEO (aceite esencial de clavo) /CS-NCs 2 (nanocápsulas de quitosano) |
CS/CEO= 1:0,75, con encapsulación del 39% cargadas con eugenol (≥ 87,2%) y β-cariofileno (≥ 9,3%), Tween 80 y TPP trifosfato de sodio (0,15% w/v), |
Bolsa no tejida con 0,5 g de CEO/CS-NCs, 4 °C, HR elevada, 15 d, No inmersión, IP-MAP |
↓ Tasa de descomposición del 6,73% y 18,08%. ↑ Vida útil en 12d. ↓ Pérdida de peso del 9.36% en 15d. ↔ Firmeza de 158,06 g en 12 d. ↔ Pérdida AsA en 15,5%. ↔ TPC y AC ↔POD/PPO |
Xu et al., 2023 |
|
Quitosano + nano TiO₂ (CTS-TiO₂) |
1 g quitosano + 1 g Nanopartículas de TiO₂ + 2 g glicerina+ ácido acético glacial 0,6% |
Inmersión 2 min, bolsa de polietileno (0,045 mm) con 6 orificios, 0 °C, 32d, HR alta y preenfriamiento 24 h a 4 °C antes del tratamiento |
↔ Firmeza, 12% de pérdida ↔ TSS y TA. ↔ AsA de 13.45 mg/100 g. ↔ TPC y AC. ↑ POD. ↓ PPO y MDA. ↓ Bacterias mesófilas hasta 25X. |
Xing et al.2021 |
|
Quitosano+ aceite esencial de tomillo+ UV-C |
9 g Quitosano +Ácido acético al 1% (v/v) + 10 g Gelatina+ Glicerol (30% p/p) + 11 mL Aceite esencial de tomillo + 11 mL Tween 80 + UV-C: 3 kJ/m² (irradiación bilateral) |
|
↔ Firmeza. ↓Actividad y expresión génica de enzimas degradantes. ↓Ablandamiento y senescencia. ↔ Degradación estructural WSP/ISP. ↑ Vida útil 56d. |
Sun et al., 2022 |
|
ChNF/LCNF/SA/TTO |
Chitosan nanofibras (ChNFs): 1 wt %+Lignocelulosa nanofibras (LCNFs) 0,5 wt % + Sodium alginate (SA) 0,5 wt % + Aceite de árbol de Té (TTO): 0,1 % w/v + Tween 80 en 0,3 % w/v |
Dispersión de nanofibras en SA a 50 °C (1 h), enfriar a 25 °C, Añadir TTO y Tween 80, homogeneizar 20 min con Ultra-Turrax, Rociar 5 mL/fruta, secar 1 h, Almacenar a 4 °C, 30% HR, hasta 15 d |
↓ Pérdida de peso 9,2% 10 d. ↑ 16,2% SSC a 15 d. ↔ Firmeza ~1,34 N. ↑ Barrera de gases (ángulo de contacto >57,5°). ↓ Degradación de azúcares y ácidos. |
Lee et al., 2024 |
|
CHN-N-Nano |
Quitosano al 1% (grado 85% deacetilación) + SiO₂ nanopartículas: 1% (15 nm) + Nisin: 1 % (en HCl 0,02 M) + Glicerol: 0,5% (plastificante) + Ácido acético: 1% (solvente) |
Inmersión 2min/fruta, secar + 28 ± 0,5 °C, 75% HR, hasta 8 d, |
↓ Encogimiento 38,5% y tasa de podredumbre del 8,61% a 8 días. ↓ Poblaciones de mohos/levaduras
y mesófilos. ↔ Vitamina C y antocianas. |
Eldib et al., 2020 |
|
CSFG (CSF + Gox) |
Carboximetil quitosano (CMCS) 1,5 wt %+ Alginato de sodio (SA) 1,5 wt % + Glicerol 0,5 wt % + CaCl₂ 2 wt % (reticulante) + Glucosa oxidasa (Gox)150 U/L |
Aplicar sobre heridas de fruto; incubar a 25 °C, HR 90%, evaluar hasta 6 d, |
↓ B. cinerea en 66,7% a 6
días. ↓Tasa de podredumbre al 33,3% a 6
días. ↑aumentados 65,3% a 2 días. |
Sun et al., 2025 |
Mantener las reservas metabólicas de la fruta resulta esencial para prolongar su vida útil. Los recubri-mientos limitan el uso de azúcares como combustible respiratorio y preservan antioxi-dantes naturales como la vitamina C y las antocianinas garantizando una mayor disponi-bilidad de sustratos para procesos celulares esenciales (Almutairi et al., 2024; Khodaei et al., 2021).
En pruebas in vivo, los frutos de arándano fueron sumergidos en soluciones de quitosano (1,5%) y ácido salicílico (5 mM) durante 2 minutos, permitiendo su secado a temperatura ambiente antes de su almacenamiento a 25 °C y 90% - 95% de humedad relativa por 10 días. Para evaluar la incidencia del hongo, los frutos fueron inoculados con 5 µL de una suspensión de B. cinerea ajustada a 10⁵ esporas/mL y posteriormente se monitoreó la tasa de descom-posición. Los resultados indicaron que la combinación de ambos compuestos redujo la incidencia de la enfermedad en un 60% en comparación con el control sin tratamiento (Ramos-Bell et al., 2022b). Estos hallazgos respaldan el potencial del quitosano y el ácido salicílico como agentes naturales para mejorar la conservación de arándanos, minimizando el impacto ambiental y cumpliendo con normativas de inocuidad alimentaria (Ramos et al., 2022a).
El quitosano y el ácido salicílico han demostrado ser una alternativa eficaz y ecológica para el control de Botrytis cinerea, un fitopatógeno agresivo responsable de pérdidas postcosecha en arándanos, especialmente debido a su resistencia a fungicidas sintéticos (Ramos-Bell et al., 2022a, 2022b). En ensayos in vitro, se utilizaron concentraciones de quitosano al 0,5%, 1,0% y 1,5% (p/v) con un grado de desacetilación del 90%, y ácido salicílico en concentraciones de 2, 3 y 5 mM, evaluando su efecto sobre el crecimiento micelial de Botrytis cinerea en agar papa dextrosa durante un período de 10 días a 25 °C (Ramos et al., 2022a). La evaluación in vivo determino que el quitosano al 1,5% y el ácido salicílico a 5mM inhibieron hasta en un 93% el crecimiento micelial del hongo y 90% de la esporulación respectivamente (Tabla 2) (Ramos et al., 2022a). Se observó que el quitosano altera la pared celular del patógeno mediante interacciones electros-táticas, mientras que el ácido salicílico promueve la producción de compuestos antimicrobianos que afectan su desarrollo (Ramos et al., 2022b). Micro-grafías electrónicas revelaron daños estructurales severos en el hongo, con deformaciones y colapso de las hifas, confirmando la acción antifúngica de los tratamientos (Ramos et al., 2022a).
Debido a sus mecanismos de acción del quitosano es una excelente alternativa para el control de enfermedades a nivel postcosecha como Alternaria spp, antracnosis Colletotrichum acutatum y moho gris Botrytis cinerea, no solo para arándano o bayas, sino que su eficacia También fue probada en fresa, mango, tomate y aguacate (Valenzuela et al., 2022).
Cuando se estima la reducción de la tasa respiratoria global, los tratamientos (Tabla 2) basados en quito-sano más UV-C y aceite esencial alcanzan una disminución del 70% - 80% y extienden la vida útil hasta 56 días; los nanosistemas de aceites esenciales alcanzan un 50% - 65% de reducción y 12 - 15 días de conservación; mientras que combinaciones más sencillas (quitosano + ácido salicílico) logran un 40% - 55% de recorte y sistemas de corta duración apenas un 30% - 45%. Estas cifras se alinean con correla-ciones claras: a mayor reducción metabólica, mayor vida útil; la conservación de la firmeza indica menos actividad enzimática degradativa; y la preservación o aumento del SSC denota un menor consumo de sustratos respiratorios.
2.3. Radiación
La radiación es una forma de energía que se propaga en ondas electromagnéticas o partículas subatómicas, existiendo radiaciones ionizantes y no ionizante. En el ámbito postcosecha de frutas y verduras, se emplea como una tecnología no térmica para mejorar la seguridad alimentaria y prolongar la vida útil de los productos frescos (Gąstoł & Błaszczyk, 2024; González-Villagra et al., 2020). Radiaciones no ioni-zantes (ultravioletas) son la parte del espectro electromagnético de 10 a 400 nm de longitudes de onda, entre la luz visible y los rayos X (Bilgin & Güneş, 2024). De acuerdo a la longitud de onda esta puede ser de tipo UV-A (315 - 400 nm), UV-B (280 - 315 nm), UV-C (200 - 280 nm) y UV-V (10 - 200 nm) (Jaramillo et al., 2021).
Las radiaciones ionizantes (rayos gamma [γ], rayos X y haces de electrones [e-beam]) causan excitación e ionización en la sustancia absorbida; a nivel postcosecha en frutas y verduras comúnmente usan radiaciones ionizantes del tipo rayos gamma de fuentes de cobalto-60 y rayos de máquinas de rayos X de hasta 5 MeV, por otro lado, los haces de electrones de aceleradores de electrones llegan hasta 10 MeV se consideran radiológicamente seguros (Jaramillo et al., 2021; Pi et al., 2021).
La radiación no ionizante del tipo UV-C (254nm) es la más empleada en postcosecha en arándanos para con-trolar inhibir la pérdida de peso, aumentar la firmeza de la fruta, retrasar el ablandamiento, aumentar los compuestos fenólicos y la actividad antioxidante, reducir la tasa respiratoria, aumentar las enzimas superóxido dismutasa (SOD), peroxidasa POD, fenilalanina amonio liasa (PAL) y polifenoloxidasa (PPO) (Bilgin & Güneş, 2024; González-Villagra et al., 2020; Liu et al., 2025; Ramos et al., 2021). Se compara radiaciones ionizantes (γ, X, e-beam) y no ionizantes (UVB, UV-C) en la calidad postcosecha del arándano (Figura 6). Las ionizantes retrasan el ablandamiento al inhibir enzimas de pared celular (PME y PG) y reducir la degradación de polisacáridos; también pueden reducir la acción del etileno y ralentizan la maduración y senescencia. Los tipos de radiación no ionizante como la UV-C actúa como sanitizante al dañar DNA/RNA microbiano y generar ROS (especies reactivas al oxigeno). UV-C y UVB inducen hormesis, activando genes de defensa y reduciendo mohos (>99% con UV-C), esto incrementa los fenoles, antocianinas y la capacidad antioxidante (SOD, CAT, APX) que mantienen la homeostasis de ROS y protegen vitamina C (Baia, et al., 2020; Chen et al., 2024; Darré et al., 2022, Ji et al., 2020). En general, la calidad final de la fruta depende de la dosis y de la respuesta fisiológica de la variedad, que pueden generar efectos no deseados en la fruta como alteraciones en el sabor y aceleración de pérdida de peso (Liu et al., 2020; Pi et al., 2021; Jaramillo et al., 2021; Gastol et al., 2024).
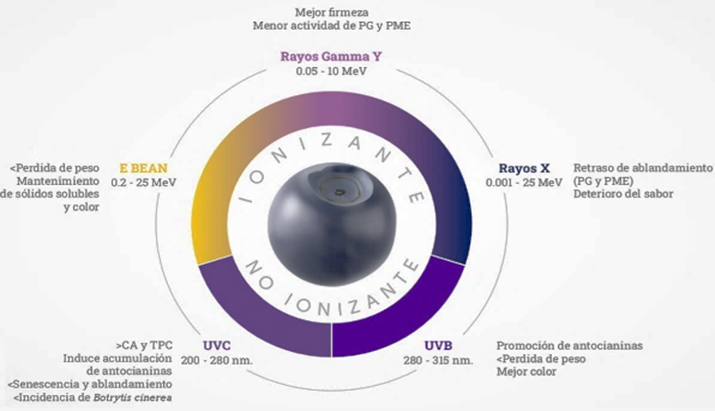
Figura 6. Efectos de radiación ionizante y no ionizante en frutos de Vacinium corymbosum. Nota. CA=Capacidad antioxidante, TPC=Contenido total de fenoles, PG= Poligalacturonasa, PME=Pectin metilesterasa.
Según por Frisón et al. (2021), la radiación UV-C (2,4 kJ m-2, 10 minutos) ha demostrado ser efectiva en el control de la flora fúngica contaminante natural en arándanos de la variedad O'Neal, además se alteró de forma ligera el pH, se aumentó en 13% la concentración de fenoles totales y la capacidad antioxidante en 8% a comparación del testigo. Esto indica su potencial para ser usado como tratamiento alternativo a tratamientos postcosecha tradicionales en este fruto.
Según Li et al. (2024), en el metaanálisis que realizaron afirman que la irradiación UV-C a 4 kJ/m2 representa la medida óptima para inhibir la tasa de respiración de las bayas, suprimir la acumulación de contenido de malondialdehído (MDA) en las bayas y mantener la acumulación de antocianinas.
Según lo recopilado en la Tabla 3, la irradiación UV-C (254 nm) se ha consolidado como una herramienta eficaz para prolongar la vida útil de los arándanos tras la cosecha. A dosis controladas, este tratamiento no térmico inhibe la pérdida de agua, mantiene la firmeza del fruto y retrasa el ablandamiento; además, aumenta significativamente los compuestos fenólicos y la actividad antioxidante en arándanos, sin afectar su color o firmeza (Frisón et al., 2021). También se ha observado la inhibición de la tasa respiratoria y del etileno, lo que contribuye a ralentizar la senescencia y la degradación de la textura (Bilgin & Güneş, 2024). Frisón et al. (2021) demostraron que una dosis de 2.4 kJ/m² de UV-C en arándanos cv. O’Neal controló la flora fúngica y mejoró atributos de calidad como el pH, los fenoles totales y la capacidad antioxidante.
A nivel fisiológico y bioquímico, la radiación modula enzimas clave relacionadas con la calidad postco-secha. El estrés inducido por radiación UV activa rutas antioxidantes endógenas, estimulando enzimas como la fenilalanina amonio liasa (PAL), polifenoloxidasa (PPO) y peroxidasa (POD), esenciales en la síntesis de compuestos protectores (Darré & Vicente, 2022). Paralelamente, las irradiaciones a bajas dosis afectan la señalización de calcio intracelular (Ca²⁺), lo que reduce la actividad de enzimas degradadoras de la pared celular como poligalacturonasa (PG) y pectina-metilesterasa (PME), retrasando así el ablandamiento del fruto (Wang et al., 2023). Esta doble acción inhibición de procesos de deterioro y activación de defensas bioquímicas explica la conservación estructural y funcional del arándano irradiado.
Además de conservar la calidad, la radiación UV-C actúa como desinfectante al inducir daños irreversibles en el ADN de bacterias y hongos, reduciendo su viabilidad (Bilgin & Güneş, 2024). También se ha estudiado el uso de radiación para estimular rutas metabólicas beneficiosas: ciertas longitudes de onda favorecen la síntesis de antocianinas, mejorando el color y valor nutracéutico del fruto (Darré & Vicente, 2022).
Se ha documentado que la irradiación UV regula la expresión de genes relacionados con el envejeci-miento, al tiempo que activa genes de defensa y respuesta al estrés (Darré & Vicente, 2022). Esta reprogramación transcripcional permite ralentizar procesos de senescencia y prolongar la vida útil del fruto, ofreciendo un enfoque no químico con potencial biotecnológico.
2.4. Ozono
El ozono (O3) es un gas oxidante en donde su producción comercial es gracias a un proceso llamado “Corona” que consiste dar escisión a las moléculas de oxígeno en el aire para formar ozono aplicando altos voltajes de corriente alterna y se produce en el mismo sitio en donde se quiere aplicar (Freitas et al., 2024). Esta tecnología se emplea para preservar la calidad y extender la vida útil de los arándanos, además ayuda a eliminar microorganismos en frutas y verduras pudiendo garantizar un producto inocuo en la industria alimentaria por sus propiedades antimicrobianas (Baia et al., 2020).
Efecto de tratamientos postcosecha con radiación en Vaccinium spp.
|
Tratamiento |
Dosis |
Longitud de onda |
Variedad |
Resultados principales |
Referencia |
|
UV-C |
2.4 kJ m⁻², 10 min |
254 nm |
O'Neal |
↓Flora fúngica. - Ligero aumento del pH. ↑ 13% fenoles totales. ↑ 8% capacidad antioxidante. |
Frisón et al. (2021) |
|
UV-C |
4 kJ m⁻² |
254 nm |
Berkeley |
- Inhibición de respiración. ↓MDA. ↑Acumulación de antocianinas. |
Li et al. (2024) |
|
UV-C continuo |
11.4 kJ/m² (15 min) |
254 nm |
O’Neal |
↓ Retraso de 6 d en podredumbre nativa y 4 d en B. cinérea. ↑ Firmeza. ↓ Pérdida de peso a 15 d |
(Jaramillo et al., 2021) |
|
UV-LED estático |
16.17 mJ/cm² (300 s) |
275 nm |
No especificada |
↓Reducción de 0.95 log CFU de E. coli; max. ↔ Sin daño al fruto a 39.5 °C. ↑ Cobertura mejorada frente a sombras. |
Haley et al., 2023 |
|
UV-B LED |
10 min (11.5 kJ/m²) |
310 nm |
Cargo |
↑ Antocianinas (+60%) y ↑ fenoles totales (+15%). ↓ Pérdida de peso (<3% a 24 h) ↑ Color más uniforme desde zona peduncular. ↔ Sin daño visible. |
Varaldo et al., 2024 |
|
UV-B + UV-C |
UV-B 11.5 kJ/m² por 10 min. UV-C 8.15 mW/m² por 10 min. |
310 y 278 nm |
Cargo |
↑ Fenoles, antocianinas y buena pigmentación superficial. ↓ pérdida de peso, especialmente al irradiar desde zona peduncular. |
Varaldo et al., 2024 |
|
UV-C LED |
1.6 kJ/m², pulso único |
278 nm |
Legacy Brigitta O’Neal |
↑ Actividad antioxidante. ↓ Pérdida de firmeza. ↓ Decaimiento sin afectar color ni sólidos solubles. - Potencial uso combinado con frío |
González-Villagra et al., 2020 |
|
e-beam |
600-800 Gy |
No aplica 10 MeV |
No especificada |
↓ pérdida de peso, ↔ sólidos solubles o color. ↔ Sin daño por frio en 21d. |
Vargas & Brison, 2023 |
|
Rayos X |
400–800 Gy (hasta 7 MeV) |
Rayos X (5–7 MeV) |
No especificado
|
- Irradiación con 7 MeV mejor distribución (DUR). ↔ No alteró color, sólidos ni pérdida de peso. - Seguro hasta en envases densos. |
Vargas & Brison, 2023 |
|
Radiación gamma (⁶⁰Co) |
0.72 kGy a 4 °C |
Gamma |
Bluecrop |
↑ Firmeza por mayor señalización de Ca²⁺. ↓ Actividad de PG y PME. ↓ Senescencia. ↑ Mejor efecto en frío. ↔ No afectó negativamente el color ni los compuestos volátiles en bajas dosis (<1 kGy). |
Wang et al., 2024 |
|
Radiación gamma (⁶⁰Co) |
2.5 kGy por 72 min |
Gamma |
Bluecrop |
↑ concentración de Ca²⁺ intracelular (máx. 778 nM a 10 h). - Redistribución subcelular: ↑ Ca en pared celular 60 %, ↓ en organelas y citoplasma. ↑ Firmeza del fruto (1.36 N a 30 d). ↓ Retarda reblandecimiento bajo refrigeración. |
Wang et al., 2023 |
|
Radiación gamma (⁶⁰Co) |
0.72 kGy por 12 min |
Gamma |
Brightwell |
↑ Preservación a 25°C. ↓ Podredumbre post-7 d. ↑VOC “frutales ↓ Aldehídos “verdes” → PPO a 4°C. |
Liu et al., 2024 |
El ozono (O₃) es un oxidante muy potente con actividad antimicrobiana, aprobado como trata-miento postcosecha para frutas por su capacidad de desactivar patógenos y retardar la maduración. En forma gaseosa, el ozono se aplica como gas en atmósfera controlada; en forma acuosa, se disuelve en agua (agua ozonizada) para lavar o rociar la fruta. La principal diferencia es que el ozono acuoso se descompone rápidamente en especies reactivas de oxígeno (ROS) como radical anión superóxido y peróxido de hidrógeno, lo que ataca microorganismos en superficie, mientras que el ozono gaseoso actúa de forma más penetrante en el aire de almacenamiento y, al descomponerse en oxígeno, no deja residuos tóxicos (Sánchez et al., 2022; Piechowiak et al., 2020). En general, el ozono prolonga la vida útil al inhibir hongos patógenos como Botrytis y Penicillium y al activar mecanismos antioxidantes de la fruta (mayor actividad de SOD, POX, CAT) (Wu et al., 2022; Piechowiak et al., 2020). Sin embargo, dosis excesivas o exposiciones muy prolongadas pueden causar estrés oxidativo y dañar tejidos internos.
El uso combinado del ozono con otras tecnologías como el quitosano y radiación ultravioleta pueden ser una alternativa de mantener su calidad a nivel postcosecha, sino también como una forma de garantizar la seguridad alimentaria de los arándanos frescos.
Además, el ozono ha demostrado tener efectos positi-vos en la mejora de las propiedades antioxidantes (superóxido dismutasa, glutatión peroxidasa y fenilalanina amoníaco-liasa) (Figura 7) de Vaccinum corymbosum L. en una concentración de 15 ppm por 30 minutos, repitiendo la aplicación cada 12 horas a 4 °C en todo el periodo de almacenaje (21 días) (Tabla 4) (Piechowiak et al., 2020).
Los tratamientos con ozono gaseoso tendieron a retrasar el deterioro de los arándanos y preservar su calidad fisicoquímica. Por ejemplo, Wu et al. (2022) observaron que la fumigación con 200 mg/m³ de ozono protegió la firmeza y ralentizó la pérdida de sólidos solubles, fenoles y antocianos durante almacenamiento. De forma similar, Piechowiak et al. (2020) demostraron que aplicaciones periódicas de ozono (15 ppm, 30 min cada 12 h) aumentaron la actividad de enzimas antioxidantes (SOD, POX, PAL) y redujeron radicales libres en los arándanos, lo que se asoció a menor crecimiento fúngico (por ejemplo, sin síntomas de Botrytis a 28 d en contraste con 27,5 % en testigo). Los tratamientos acuosos produjeron principalmente cambios en la superficie; Contigiani et al. (2022) reportaron alteraciones químicas en las ceras epicuticulares debidas al ozono acuoso, sin afectar el color ni el sabor del fruto (Sánchez et al., 2022). Por otro lado, la combinación de ozono con atmósfera modificada fue especialmente promete-dora. Pinto et al. (2020) encontraron que ozonizar los arándanos antes del envasado y luego almacenarlos en MAP redujo significativamente mohos y levaduras, al tiempo que conservó mejor los antocianos durante 15 d. En conjunto, los datos indican que el ozono –tanto gaseoso como en agua– puede extender la vida útil de los arándanos postcosecha mediante reducción microbiana y activación de defensas antioxidantes, siempre que se ajusten correctamente dosis y tiempo de contacto.

Figura 7. Efectos del ozono en frutos de Vacinium corymbosum. Nota. SOD= Superóxido Dismutasa, POX= Glutatión Peroxidasa, CAT= Fenilalanina Amoníaco-Liasa.
Tabla 4
Efecto de tratamientos postcosecha con ozono en Vaccinium spp.
|
Tipo de tratamiento |
Dosis / Composición |
Condiciones (T°, HR, tiempo, duración) |
Variedad |
Efecto principal sobre la fruta |
Referencia (autor, año) |
|
Gaseoso (fumigación) |
200 mg/m³ ozono, 60 min |
4 °C, 80 días almacenamiento |
No especificada |
↓ Penicillium, ↑ firmeza, ↓ pérdida de sólidos solubles, fenoles y antocianos |
Wu et al., 2022 |
|
Gaseoso (periódico) |
15 ppm ozono, 30 min cada 12 h |
4 °C, 28 días almacenamiento |
‘Bluecrop’ |
↑ SOD, POX, PAL, ↓ ROS; 0% moho a 28 d (vs 27,5% testigo) |
Piechowiak et al., 2020 |
|
Gaseoso |
0,01 mL/L (~10 ppm) ozono, 30 min |
4 °C, 14 días almacenamiento |
‘Duke’ |
↑ fenoles (+16% – 34%), antocianinas y azúcares (+6%) |
Sánchez et al., 2022 |
|
Acuoso (lavado) |
5,1 mg/L ozono, 10 min |
4 °C, 15 días almacenamiento |
‘Duke’ |
Alteraciones en cera epicuticular, sin afectar color; ligera reducción microbiana |
Sánchez et al., 2022 |
|
Gaseoso + MAP (combinado) |
6 ppm ozono, 16 h (pretratamiento) |
1 °C pretratamiento, luego MAP (10 kPa O₂, 40 kPa CO₂), 15 d a 4 °C |
‘Bluecrop’ |
↓ mohos y levaduras, conservación de antocianinas sin afectar parámetros de calidad |
Pinto et al., 2020 |
|
Gaseoso (varios tiempos) |
0,7–4,3 ppm ozono (según tiempo) |
10 °C, 90 % HR, 20–30 días almacenamiento |
No especificada |
1,4 ppm por 20 min: ↓ pudriciones (24% infectado vs 80% en control a 30 días) |
Lemic et al., 2025 |
CONCLUSIONES
Se conocieron las tasas de respiración de variedades de Vaccinium corymbosum, identificando que temperaturas superiores a 20 °C, HR inferiores a 90% y superiores a 95%, niveles de CO2 mayores a 20% y O2 en concentraciones menores a 3% son los principales factores abióticos que afectan la tasa de respiración y en consecuencia la vida postcosecha del fruto.
Se describieron las principales tecnologías MAP, quitosano, radiación y ozono que aumentan la duración postcosecha de frutos de Vaccinium corymbosum L., sea inhibiendo o reduciendo de forma indirecta la respiración, eliminando o reduciendo el desarrollo de microorganismos y mohos, conser-vando la firmeza, manteniendo calidad sensorial o aumentando el contenido de antioxidantes.
Se deben realizar futuros estudios para evaluar la interacción entre la tasa de respiración y las tecnologías postcosecha, considerando las distintas variedades de arándano que pueden ser optimizadas según su genotipo para maximizar la vida útil.
REFERENCIAS BIBLIOGRÁFICAS
Almasoud, W. A., Abdel-Sattar, M., Khalifa, S. M., Dawood, A. S., Shahda, M. A., El-Taher, A. M., Haikal, A., Rihan, H., & Ahmed, A. F. (2024). Influence of Salicylic Acid and Melatonin During Postharvest Refrigeration on Prolonging Keitt Mango Freshness. Sustainability, 16(23), 10675. https://doi.org/10.3390/su162310675
Almutairi, K. F., Alharbi, A. R., Abdelaziz, M. E., & Mosa, W. F. A. (2024). Salicylic acid and chitosan effects on fruit quality when applied to fresh strawberry or during different periods of cold storage. BioResources 19(3), 6057-6075. https://doi.org/10.15376/biores.19.3.6057-6075
Anaya-Esparza, L.M., Pérez-Larios, A., Ruvalcaba-Gómez, J. M., et al. (2020). Funcionalización de recubrimiento comestible a base de quitosano para la conservación postcosecha de frutas y hortalizas. TIP Rev Esp Cienc Quim Biol., 23(1), 1-14. https://doi.org/10.22201/fesz.23958723e.2020.0.241
Anthony, B. M., Kim, Y. K., & Minas, I. S. (2024). Evaluating low pressure storage for prolonging the postharvest life of blueberries. Scientia Horticulturae, 337 https://doi.org/10.1016/j.scienta.2024.113535
Azari, H., Morovati, A., Gargari, B. P., & Sarbakhsh, P. (2022). Beneficial effects of blueberry supplementation on the components of metabolic syndrome: a systematic review and meta-analysis. Food & function, 13(9), 4875-4900. https://doi.org/10.1039/D1FO03715C
Baia, G. M., Freitas-Silva, O., & Junior, M. F. (2020). Understanding the role of chlorine and ozone to control postharvest diseases in fruit and vegetables: A review. Current Nutrition & Food Science, 16(4), 455-461. https://doi.org/10.2174/1573401315666190212161209
Bilgin, A. B., & Güneş, G. (2024). Effects of ultraviolet–C treatment on postharvest physiologies and decay of berries: A review. ITU Journal of Food Science and Technology, 2(2), 85-100.
Brizzolara, S., Manganaris, G. A., Fotopoulos, V., Watkins, C. B., & Tonutti, P. (2020). Primary metabolism in fresh fruits during storage. Frontiers in plant science, 11, 80. https://doi.org/10.3389/fpls.2020.00080
Brondino, L., Briano, R., Massaglia, S., & Giuggioli, N. R. (2022). Influence of harvest method on the quality and storage of highbush blueberry. Journal of Agriculture and Food Research, 10, 100415. https://doi.org/10.1016/j.jafr.2022.100415
Cai, Y., Takeda, F., Foote, B., & DeVetter, L. W. (2021). Effects of Machine-Harvest Interval on Fruit Quality of Fresh Market Northern Highbush Blueberry. Horticulturae, 7(8), 245. https://doi.org/10.3390/horticulturae7080245
Chaiwong, N., Leelapornpisid, P., Jantanasakulwong, K., Rachtanapun, P., Seesuriyachan, P., Sakdatorn, V., Leksawasdi, N., & Phimolsiripol, Y. (2020). Antioxidant and moisturizing properties of carboxymethyl chitosan with different molecular weights. Polymers, 12(7), 1445. https://doi.org/10.3390/polym12071445
Chen, D., Zhang, Y., Zhao, J., Liu, L., & Zhao, L. (2024). Research progress on physical preservation technology of fresh-cut fruits and vegetables. Horticulturae, 10(10), 1098. https://doi.org/10.3390/horticulturae10101098
Chen, Z., Xu, Y., Lu, Y., Miao, Z., Yi, Y., Wang, L., Hou, W., Ai, Y., Wang, H., & Min, T. (2022). Effect and mechanism of eugenol on storage quality of fresh-peeled Chinese water chestnuts. Frontiers in Plant Science, 13, 965723. https://doi.org/10.3389/fpls.2022.965723
Czerwiński, K., Rydzkowski, T., Wróblewska-Krepsztul, J., & Thakur, V. K. (2021). Towards impact of modified atmosphere packaging (MAP) on shelf-life of polymer-film-packed food products: Challenges and sustainable developments. Coatings, 11(12), 1504. https://doi.org/10.3390/coatings11121504
Dai, L., Wang, X., Zhang, J., & Li, C. (2025). Application of Chitosan and Its Derivatives in Postharvest Coating Preservation of Fruits. Foods, 14(8), 1318. https://doi.org/10.3390/foods14081318
Darré, M., Vicente, A. R., Cisneros-Zevallos, L., & Artés-Hernández, F. (2022). Postharvest ultraviolet radiation in fruit and vegetables: Applications and factors modulating its efficacy on bioactive compounds and microbial growth. Foods, 11(5), 653. https://doi.org/10.3390/foods11050653
Duan, Y., Tarafdar, A., Chaurasia, D., Singh, A., Bhargava, P. C., Yang, J., Li, Z., Ni, X., Tian, Y., Li, H., & Awasthi, M. K. (2022). Blueberry fruit valorization and valuable constituents: A review. International Journal of Food Microbiology, 381, 109890. https://doi.org/10.1016/j.ijfoodmicro.2022.109890
Eldib, R., Khojah, E., Elhakem, A., Benajiba, N., & Helal, M. (2020). Chitosan, nisin, silicon dioxide nanoparticles coating films effects on blueberry (Vaccinium myrtillus) quality. Coatings, 10(10), 962. https://doi.org/10.3390/coatings10100962
Falagán, N., Miclo, T., & Terry, L. A. (2020). Graduated controlled atmosphere: A novel approach to increase “Duke” blueberry storage life. Frontiers in plant science, 11, 514750. https://doi.org/10.3389/fpls.2020.00221
Fang, Y., & Wakisaka, M. (2021). A review on the modified atmosphere preservation of fruits and vegetables with cutting-edge technologies. Agriculture, 11(10), 992. https://doi.org/10.3390/agriculture11100992
Farneti, B., Khomenko, I., Ajelli, M., Degasperi, M., Betta, E., Biasioli, F., & Giongo, L. (2025). Ester content of blueberry fruit can be ruled by tailored controlled atmosphere storage management. Postharvest Biology and Technology, 222, 113355. https://doi.org/10.1016/j.postharvbio.2024.113355.
Forney, C. F., Jordan, M. A., Pennell, K. M., & Fillmore, S. (2022). Controlled atmosphere storage impacts fruit quality and flavor chemistry of five cultivars of highbush blueberry (Vaccinium corymbosum). Postharvest Biology and Technology, 194, 112073. https://doi.org/10.1016/j.postharvbio.2022.112073
Freitas-Silva, O., de Souza Coelho, C. C., Trombete, F. M., & de Souza, A. M. (2024). Current development in ozone-based food preservation. In Food Packaging and Preservation Antimicrobial Materials and Technologies. 235-258 pp. https://doi.org/10.1016/B978-0-323-90044-7.00013-6
Frisón, L. N., Rivas, M. Z., Chiericatti, C. A., & Piagentini, A. M. (2021). Efecto de la radiación UV-C sobre la calidad y la flora fúngica contaminante natural de arándanos (Vaccinium corymbosum L., variedad O’Neal). INNOTEC, 22, e575. https://doi.org/10.26461/22.06
Gąstoł, M., & Błaszczyk, U. (2024). Effect of magnetic field and UV-C radiation on postharvest fruit properties. Agriculture, 14(7), 1167. https://doi.org/10.3390/agriculture14071167
González-Villagra, J., Reyes-Díaz, M., Alberdi, M., Mora, M. L., Ulloa-Inostroza, E. M., & Ribera-Fonseca, A. E. (2020). Impact of cold-storage and UV-C irradiation postharvest treatments on quality and antioxidant properties of fruits from blueberry cultivars grown in Southern Chile. Journal of Soil Science and Plant Nutrition, 20, 1751-1758. https://doi.org/10.1007/s42729-020-00247-5
Haddaway, N. R., Page, M. J., Pritchard, C. C., & McGuinness, L. A. (2022). PRISMA2020: An R package and Shiny app for producing PRISMA 2020-compliant flow diagrams, with interactivity for optimised digital transparency and open synthesis. Campbell Systematic Reviews, 18, e1230. https://doi.org/10.1002/cl2.1230
Hahn, T., Tafi, E., Paul, A., Salvia, R., Falabella, P., & Zibek, S. (2020). Current state of chitin purification and chitosan production from insects. Journal of Chemical Technology & Biotechnology, 95(11), 2775-2795. https://doi.org/10.1002/jctb.6533
Haley, O. C., Pliakoni, E. D., Rivard, C., Nwadike, L., & Bhullar, M. (2023). The attenuation of microbial reduction in blueberry fruit following UV-LED treatment. Journal of Food Protection, 86(3), 100056. https://doi.org/10.1016/j.jfp.2023.100056
Hu, X., Sun, H., Yang, X., Cui, D., Wang, Y., Zhuang, J., Wang, X., Ma, R., & Jiang, L. (2021). Potential use of atmospheric cold plasma for postharvest preservation of blueberries. Postharvest Biology and Technology, 10(12). https://doi.org/10.1016/j.postharvbio.2021.111564
Izadi, H., Asadi, H., & Bemani, M. (2025). Chitin: a comparison between its main sources. Frontiers in Materials, 12. https://doi.org/10.3389/fmats.2025.1537067
Jaramillo, G., Contigiani, E. V., Coronel, M. B., Alzamora, S. M., García-Loredo, A., & Nieto, A. B. (2021). Study of UV-C treatments on postharvest life of blueberries ‘O'Neal’and correlation between structure and quality parameters. Heliyon, 7(6). https://doi.org/10.1016/j.heliyon.2021.e07190
Ji, Y., Hu, W., Liao, J., Jiang, A., Xiu, Z., Gaowa, S., Guan, Y., Yang, X., Feng, K., & Liu, C. (2020). Effect of atmospheric cold plasma treatment on antioxidant activities and reactive oxygen species production in postharvest blueberries during storage. Journal of the Science of Food and Agriculture, 100(15), 5586-5595. https://doi.org/10.1002/jsfa.10611
Khodaei, D., Hamidi-Esfahani, Z., & Rahmati, E. (2021). Effect of edible coatings on the shelf-life of fresh strawberries: A comparative study using TOPSIS-Shannon entropy method. NFS Journal, 23, 17-23. https://doi.org/10.1016/j.nfs.2021.02.003
Kowalczyk, B. A., Bieniasz, M., & Błaszczyk, J. (2025). Effect of Short-Term Storage in Modified Atmosphere Packaging (MAP) and Controlled Atmosphere (CA) on Total Polyphenol Content and Antioxidant Activity of Highbush Blueberry (Vaccinium corymbosum L.). Fruit. Foods, 9(3). https://doi.org/10.3390/agriculture15030253
Lare, M., Urroz, K., Rivadeneira, M., Bof, M., & Bello, F. (2023). Tasa respiratoria y producción de etileno durante la maduración de frutos de arándanos cultivados en el NEA. Investigación Joven, 10(2), 114.
Lemic, D., Zorić, B., Novak, A., Ivić, D., Andrijana, M., Viric, H. (2025). The Effectiveness of Ozone Technology Application in Extending the Shelf Life of Berry Fruit. Applied Fruit Science, 67, 35. https://doi.org/10.1007/s10341-025-01278-x
Li, J., Liu, G., Huang, Y., Pan, Q., Bai, Z., Li, C., Luo, H., & Xue, W. (2024) Comprehensive Evaluation of Optimized Preservation Strategies for Blueberries: An Assessment of Diverse Intervention Measures Based on Network Meta-Analysis. SSRN. https://dx.doi.org/10.2139/ssrn.5035323
Liao, J., Hou, B., & Huang, H. (2022). Preparation, properties and drug controlled release of chitin-based hydrogels: An updated review. Carbohydrate Polymers, 283, 119177. https://doi.org/10.1016/j.carbpol.2022.119177
Liu, C., Ding, J., Huang, P., Li, H., Liu, Y., Zhang, Y., Hu, X., Deng, S., Liu, Y., & Qin, W. (2023). Use of heat-shock and edible coating to improve the postharvest preservation of blueberries. Foods, 12(4), 789. https://doi.org/10.3390/foods12040789
Liu, D., Liu, Z., Lan, B., Ma, L., Huang, H., Xiao, G., Wang, Q., & Wang, F. (2024). 60Co γ-radiation at low-dose level alters volatile compounds of blueberry during storage. International Journal of Food Science and Technology, 59(6), 4081-4092. https://doi.org/10.1111/ijfs.17164
Liu, M., Zhang, A., Yu, H., Zeng, Q., & Liu, X. (2025). Postharvest application of ultraviolet-A and blue light irradiations boosted the accumulation of acetylated anthocyanins in the blueberry fruit and its potential regulatory mechanisms. Postharvest Biology and Technology, 222, 113371. https://doi.org/10.1016/j.postharvbio.2024.113371
Millas, P., Barra-Bucarei, L., Castro, J. F., Carrasco-Fernández, J., Chilian, J., Tapia, E., Santelices, C., Cisterna, V., Muñoz, V., Campos, J., Parra, K., & France, A. (2023). Identification and distribution of species of Neofusicoccum that cause blueberry stem blight in Chile. Mycologia, 115(3), 326-339. https://doi.org/10.1080/00275514.2023.2180976
Miles, T. D., & Hancock, J. F. (2022). Inheritance of resistance to anthracnose fruit rot caused by Colletotrichum fioriniae in highbush blueberry. International Journal of Fruit Science, 22(1), 160-169. https://doi.org/10.1080/15538362.2021.2022567
Moggia, C., & Lobos, G. A. (2023). Why measuring blueberry firmness at harvest is not enough to estimate postharvest softening after long term storage? A review. Postharvest Biology and Technology, 198, 112230. https://doi.org/10.1016/j.postharvbio.2022.112230
Munira, S., Khan, S. A. K. U., & Kabir, M. Y. (2024). Chitosan Maintains Postharvest Quality and Improves the Shelf Life of Fruits. Khulna University Studies, 21(2), 85-94. https://doi.org/10.53808/KUS.2024.21.02.1278-ls
Pellis, A., Guebitz, G. M., & Nyanhongo, G. S. (2022). Chitosan: sources, processing and modification techniques. Gels, 8(7), 393. https://doi.org/10.3390/gels8070393
Pi, X., Yang, Y., Sun, Y., Wang, X., Wan, Y., Fu, G., ... & Cheng, J. (2021). Food irradiation: A promising technology to produce hypoallergenic food with high quality. Critical Reviews in Food Science and Nutrition, 62(24), 6698-6713. https://doi.org/10.1080/10408398.2021.1904822
Piechowiak, T., Skóra, B., & Balawejder, M. (2020). Ozone treatment induces changes in antioxidative defense system in blueberry fruit during storage. Food and Bioprocess Technology, 13, 1240-1245. https://doi.org/10.1007/s11947-020-02450-9
Pinto, L., Palma, A., Cefola, M., Pace, B., D'Aquino, S., Carboni, C., & Baruzzi, F. (2020). Effect of modified atmosphere packaging (MAP) and gaseous ozone pre-packaging treatment on the physico-chemical, microbiological and sensory quality of small berry fruit. Food Packaging and Shelf Life, 26, 100573. https://doi.org/10.1016/j.fpsl.2020.100573
Pratap-Singh, A., Shojaei, M., Singh, A., Ye, Y., Mandal, R., Yan, Y., & Castellarin, S. D. (2023). Effects of pulsed light on the postharvest quality and shelf-life of highbush blueberries (cv. Draper). Applied Food Research, 3(1) https://doi.org/10.1016/j.afres.2023.100273
Ramos, S. R., Hernández, L. G. H., Gonzales, R. R. G., & Gutiérrez , P. G. (2021). Main diseases in postharvest blueberries, conventional and eco-friendly control methods: A review. Lwt, 149, 112046. https://doi.org/10.1016/j.lwt.2021.112046
Ramos-Bell, S., Hernández-Montiel, L. G., Velázquez-Estrada, R. M., Sánchez-Burgos, J. A., Bautista-Rosales, P. U., & Gutiérrez-Martínez, P. (2022b). Additive effect of alternative treatment to chemical control of Botrytis cinerea in blueberries. Revista Mexicana de Ingeniería Química, 21(3). https://doi.org/10.24275/rmiq/Bio2839
Ramos-Bell, S., Velázquez-Estrada, R. M., Hernández-Montiel, L. G., & Gutiérrez-Martínez, P. (2022a). Efecto antifúngico de quitosano y ácido salicílico sobre Botrytis cinerea aislado de arándano (Vaccinium corymbosum). Revista Mexicana de Ingeniería Química. e-Gnosis, 4, 1-5
Ramos-Bell, S., Diaz-Cayetano, G., Hernández-Montiel, L. G., Velázquez-Estrada, R. M., Montalvo-González, E., & Gutiérrez-Martínez, P. (2024). Conservación fisicoquímica de arándanos tratados con quitosano y ácido salicílico en poscosecha. Revista mexicana de ciencias agrícolas, 15(5). https://doi.org/10.29312/remexca.v15i5.3391
Ramos-Bell, S., Diaz, G., Hernández, L, Velázquez, R., Montalvo, E., & Gutiérrez, P. (2024). Conservación fisicoquímica de arándanos tratados con quitosano y ácido salicílico en poscosecha. Revista mexicana de ciencias agrícolas, 15(5), https://doi.org/10.29312/remexca.v15i5.3391
Rasweefali, M. K., Sabu, S., Azad, K. M., Rahman, M. R., Sunooj, K. V., Sasidharan, A., & Anoop, K. K. (2022). Influence of deproteinization and demineralization process sequences on the physicochemical and structural characteristics of chitin isolated from Deep-sea mud shrimp (Solenocera hextii). Advances in Biomarker Sciences and Technology, 4, 12-27. https://doi.org/10.1016/j.abst.2022.03.001
Rivera, S., Kerckhoffs, H., Sofkova-Bobcheva, S., Hutchins, D., & East, A. (2022). Influencia de la madurez de la cosecha y la tecnología de almacenamiento en las propiedades mecánicas de los arándanos. Biología y Tecnología de Poscosecha, 191, 111961. https://doi.org/10.1016/j.postharvbio.2022.111961
Rodas, A., Chavarro Porras, J. C., & Guerrero Álvarez, G. E. (2024). Desarrollo de plataforma de bajo costo para el monitoreo de condiciones microclimáticas favorables al surgimiento del hongo Botrytis Cinerea en el cultivo de mora de Castilla departamento Risaralda. Encuentro Internacional De Educación En Ingeniería. https://doi.org/10.26507/paper.3521
Romero, J., Albertos, I., Díez-Méndez, A., & Poveda, J. (2022). Control of postharvest diseases in berries through edible coatings and bacterial probiotics. Scientia Horticulturae, 304, 111326. https://doi.org/10.1016/j.scienta.2022.111326
Sánchez, G. J., Contigiani, E. V., Alzamora, S. M., & Santagapita, P. R. (2022). Changes on epicuticular waxes and colour induced by ozone in blueberries (Vaccinium corymbosum L.‘O’Neal’). Journal of Food Composition and Analysis, 108, 104404. https://doi.org/10.1016/j.jfca.2022.104404
Sharma, S., Nakano, K., Kumar, S., & Katiyar, V. (2024). Edible packaging to prolong postharvest shelf-life of fruits and vegetables: A review. Food Chemistry Advances, 100711. https://doi.org/10.1016/j.focha.2024.100711
Silva, S., Costa, E. M., Veiga, M., Morais, R. M., Calhau, C., & Pintado, M. (2020). Health promoting properties of blueberries: A review. Critical reviews in food science and nutrition, 60(2), 181-200. https://doi.org/10.1080/10408398.2018.1518895
Smrke, T., Cvelbar Weber, N., Veberic, R., Hudina, M., & Jakopic, J. (2021). Modified atmospheric CO2 levels for maintenance of fruit weight and nutritional quality upon long-term storage in blueberry (Vaccinium corymbosum l.) Liberty’. Horticulturae, 7(11), 478. https://doi.org/10.3390/horticulturae7110478
Stull, A. J., Cassidy, A., Djousse, L., Johnson, S. A., Krikorian, R., Lampe, J. W., Mukamal, K., Nieman, D., Porter, K., Rasmussen, H., Rimm, E., Stote, K & Tangney, C. (2024). The state of the science on the health benefits of blueberries: a perspective. Frontiers in Nutrition, 11, 1415737. https://doi.org/10.3389/fnut.2024.1415737
Sun, H., Hao, D., Tian, Y., Huang, Y., Wang, Y., Qin, G., Pei, J., & Abd El-Aty, A. M. (2022). Effect of chitosan/thyme oil coating and UV-C on the softening and ripening of postharvest blueberry fruits. Foods, 11(18), 2795. https://doi.org/10.3390/foods11182795
Sun, J., Wang, T., Liu, L., Li, Q., Liu, H., Wang, X., Liu, M., & Zhang, H. (2025). Preparation and Application of Edible Chitosan Coating Incorporating Natamycin. Polymers, 17(8), 1062. https://doi.org/10.3390/polym17081062
Tan, Y., Wang, X., Li, L., Zhang, Z., Wang, X., Wang, Y., Li, Y., & Bi, Y. (2025). Postharvest combined chitosan and melatonin treatment maintain antioxidant capacity and cell membrane integrity of fresh-cut broccoli by inducing reactive oxygen species scavenging system. LWT, 220, 117572. https://doi.org/10.1016/j.lwt.2025.117572
Tobar‐Bolaños, G., Casas‐Forero, N., Orellana‐Palma, P., & Petzold, G. (2021). Blueberry juice: Bioactive compounds, health impact, and concentration technologies—A review. Journal of food science, 86(12), 5062-5077. https://doi.org/10.1111/1750-3841.15944
Toledo-Guerrero, J. D., Álvarez, M. D., Herranz, B., Escribano, M. I., Merodio, C., Romero, I., & Sanchez-Ballesta, M. T. (2024). Effect of Short-Term High-CO2 Treatments on the Quality of Highbush and Rabbiteye Blueberries During Cold Storage. Plants, 13(23), 3398. https://doi.org/10.3390/plants13233398
Torres-Rodriguez, J. A., Reyes Pérez, J. J., Ramos, L. T. L., Gonzalo-Matute, L., Rueda-Puente, E. O., & Hernandez-Montiel, L. G. (2025). Chitosan as a Postharvest Alternative for the Control of Phytophthora capsici in Bell Pepper Fruits. Sci, 7(2), 37. https://doi.org/10.3390/sci7020037
Valenzuela-Ortiz, G., Gaxiola-Camacho, S. M., San-Martín-Hernández, C., Martínez-Téllez, M. Á., Aispuro-Hernández, E., Lizardi-Mendoza, J., & Quintana-Obregón, E. A. (2022). Chitosan sensitivity of fungi isolated from mango (Mangifera indica L.) with anthracnose. Molecules, 27(4), 1244. https://doi.org/10.3390/molecules27041244
Varaldo, A., Alchera, F., Giuggioli, N. R., & Giacalone, G. (2024). LED UVB postharvest treatments modify nutraceutical quality and physical properties of ‘Cargo’blueberries. Journal of Agriculture and Food Research, 15, 101040. https://doi.org/10.1016/j.jafr.2024.101040
Varela, R., Vidal, C., Larroca, A., García, C., & Albornoz, N. (2022). Tasa respiratoria de arándanos en condiciones aeróbicas. Influencia varietal y modelización. Ciencia, Docencia Y Tecnología Suplemento, 11(12), 1-27.
Vargas Rivadeneira, A., & Brison, J. (2023). X-Ray and E-Beam Irradiation for Phytosanitary Control in Navel Oranges and Blueberries. Jérémy, X-Ray and E-Beam Irradiation for Phytosanitary Control in Navel Oranges and Blueberries. SSRN. https://dx.doi.org/10.2139/ssrn.4540863
Wang, C., Tao, Y., Han, Y., Zhang, R., Li, L., & Gao, Y. (2023). Influences of subcellular Ca redistribution induced by γ irradiation on the fruit firmness of refrigerated blueberries. Postharvest Biology and Technology, 195, 112146. https://doi.org/10.1016/j.postharvbio.2022.112146
Wang, C., Zhang, S., Han, Y., Li, L., Ban, Z., & Lu, P. (2024). γ irradiation mediated the inhibitory effect of Ca2+ signals on softening of blueberry fruit during cold storage. Food Bioscience, 57, 103513. https://doi.org/10.1016/j.fbio.2023.103513
Wang, J., Yuan, Y., Liu, Y., Li, X., & Wu, S. (2024). Application of chitosan in fruit preservation: A review. Food chemistry: X, 101589. https://doi.org/10.1016/j.fochx.2024.101589
Wang, Y., Acharya, T., Malladi, A., Tsai. H., NeSmith, D., Doyle, J., and Nambeesan, S. (2022). Atypical Climacteric and Functional Ethylene Metabolism and Signaling During Fruit Ripening in Blueberry (Vaccinium sp.). Plant Sci. 13, 1-15. https://doi.org/10.3389/fpls.2022.932642
Wei, Z., Yang, H., Shi, J., Duan, Y., Wu, W., Lyu, L., & Li, W. (2023). Effects of different light wavelengths on fruit quality and gene expression of anthocyanin biosynthesis in blueberry (Vaccinium corymbosm). Cells, 12(9), 1225. https://doi.org/10.3390/cells12091225
Wu, W., Cao, S., Chen, H., Ruan, L., Lei, Q., Xu, S., & Li, J. (2022). Effects of ozone fumigation on the main postharvest pathogenic fungi Penicillium sp. and the storage quality of blueberry in Majiang county, China. Frontiers in Plant Science, 13, 898994. https://doi.org/10.3389/fpls.2022.898994
Xing, Y., Yang, S., Xu, Q., Xu, L., Zhu, D., Li, X., Shui, Y., Liu, X., & Bi, X. (2021). Effect of chitosan/Nano-TiO2 composite coating on the postharvest quality of blueberry fruit. Coatings, 11(5), 512. https://doi.org/10.3390/coatings11050512
Xu, Y., Chen, H., Zhang, L., & Xu, Y. (2023). Clove essential oil loaded chitosan nanocapsules on quality and shelf-life of blueberries. International Journal of Biological Macromolecules, 249, 126091. https://doi.org/10.1016/j.ijbiomac.2023.126091
Yan, D., Li, Y., Liu, Y., Li, N., Zhang, X., & Yan, C. (2021). Antimicrobial properties of chitosan and chitosan derivatives in the treatment of enteric infections. Molecules, 26(23), 7136. https://doi.org/10.3390/molecules26237136
Yan, T., Ren, Y., Zhang, R., Li, K., Yang, B., Tong, M., & He, J. (2025). Biodegradable chitosan-based films decorated with biosynthetic copper oxide nanoparticle for post-harvest tomato preservation. International Journal of Biological Macromolecules, 295, 139595. https://doi.org/10.1016/j.ijbiomac.2025.139595
Yan, X., Yan, J., Pan, S., & Yuan, F. (2020). Changes of the aroma composition and other quality traits of blueberry ‘garden blue’during the cold storage and subsequent shelf life. Foods, 9(9), 1223. https://doi.org/10.3390/foods9091223
Zhang, W., Jiang, H., Cao, J., & Jiang, W. (2021). UV-C treatment controls brown rot in postharvest nectarine by regulating ROS metabolism and anthocyanin synthesis. Postharvest Biology and Technology, 180, 111613. https://doi.org/10.1016/j.postharvbio.2021.111613